深度解密PD-1抗体
上个月,2018诺贝尔生理学或医学奖授予了美国的James Allison和日本的Tasuku Honjo教授,以表彰两位及其团队在肿瘤免疫治疗上的巨大贡献。
以PD-1单克隆抗体为代表的免疫疗法,自2014年诞生以来,让全世界都见识到了其在肿瘤治疗方面的巨大潜力。一时间,国内外药企加入了这条研发赛道,各家PD-1或初战告捷或蓄势待发。已登陆的O药和K药不消多说,就是处于在研阶段的新药也如恒河沙数。
面对这些如雨后春笋般涌现的同类药物,除了临床试验以外, 就没有其他评价方式来帮助我们评价它们的好坏吗?
当然不是。要知道从杂交瘤技术出现至今,治疗性单克隆抗体的制备技术已经数次迭代,单抗“生来如何”基本决定了能走多远,我们也拥有了一套通用的临床前评估标准,可以借此对药物在临床上的表现作出预估。今天咱们就以几个国内外的PD-1抑制剂为例,来唠唠单抗的制备技术和临床前特征。想讲清楚这其中的故事,还得从单抗的结构说起,毕竟结构是功能的基础嘛。
结构决定功能
绝大多数治疗性抗体都是IgG。IgG由四条肽链组成,两重两轻,每条链又可分为恒定区(CH/CL)与可变区(VH/VL),这就是抗体最基础的结构了。在这个基础上,每个可变区内又存在三个短多肽链形成的互补决定区(CDR),与可变区的其他部分相比,CDR序列可变性更高。可以说可变区决定了抗体的抗原结合能力,而CDR又是核心中的核心。
说起来抗体的结构还真是挺复杂的,不是人力可以完美仿造的。要知道,抗体的多个结构域都是相对独立、模块化的,每个部分的组成都在基因组中有复数的备份,特别是CDR,CDR自己可以分为V、D、J三种片段,它们的组合给了CDR超级丰富的变化,我们把这叫做VDJ重组。这还不是最大的“杀器”。当被抗原激活,生产抗体的B细胞开始迅速增殖,它们编码可变区的基因将会以远超其他细胞的速度开始突变,这种名为体细胞超突变(SHM)的过程使得B细胞每一次分裂产生的后代都微妙地有所不同。随后,辅助T细胞则会对B细胞进行进一步选择,只有那些产生高亲和力抗体的B细胞才能获得资源存活下来,这个过程叫亲和力成熟。
免疫系统的大智慧还有更多,咱们今天了解这些就够了。所以说,机体内能够以一套极其高效率的程式快速瞄准抗原生产具有足够治疗效率的抗体,这是体外“手工”优化比不了的。
不过也好在抗体这种乐高一样的模块化结构,这给了我们借助科技改造它的机会。
从小鼠到人
人类对抗体的了解实在是走得太慢了。十九世纪末,才有科学家模模糊糊摸到了体液免疫的衣摆,又过了一百年,第一个单抗药物才正式面世。不过后面的故事我们也知道,这款药物之后,FDA 9年没敢再碰单抗,没有别的原因,就是副作用太大了,病人消受不起。最早的蛇毒血清其实是马的血清,幸运的是你很难被同一种毒蛇咬两次,单抗药物就不一样了,一般来说只要用了就得是持续使用。
第一个单抗药得益于当时出现不久的杂交瘤技术,单纯来说它就是一种小鼠产生的、小鼠自己的抗体,首先它不一定完美契合人类抗原,其次给人输进去,人体也会产生针对它的抗药抗体(ADA),好一点就是越用越没用,坏一点再引发个超敏反应,病人性命堪忧。
从此科学家开始了从鼠到人的探索。
这里抗体的模块化结构就派上用场了。起先科学家是把小鼠抗体的可变区揪下来,和人类抗体的恒定区连在一起,这样生成的单抗实际上60%到70%都是人类的了,免疫原性已经大大降低了,这就是嵌合抗体的诞生。
现代的抗体制备技术已经又前进了两步了,一是替换程度已经精细到CDR的人源化抗体,一是全人源抗体。人源化抗体已经有90%以上都是人类的了,全人源则故名思义,百分百人类,理论上几乎不会引发不必要的免疫反应。
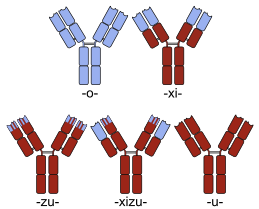
这里还可以教大家一个从名识类别的小诀窍。单抗们的通用名都巨老长,一眼看过去令人头昏眼花,咱们可以把它们拆一拆。首先最末尾的mab大家肯定都晓得了,就是单抗的意思,再往前看两个字母,这里边就藏着大秘密。根据单抗命名法则,这俩字母如果是xi,那它就是个嵌合抗体;如果是zu,说明是一种人源化抗体;如果只有一个u,那恭喜你了,这是一款全人源抗体。
举个例子,刚来中国不久的O药和K药,前者通用名nivolumab,可见是个全人源单抗,后者pembrolizumab,咱们就知道它是个人源化抗体了。
通向全人源的两条大路
从人源化到全人源,虽说只是不到10%的差异但却难比登天,毕竟我们不能直接免疫人体获得抗体。
在这里科学家们选择了两条截然不同的道路——噬菌体展示和转基因小鼠。前者利用了噬菌体/原核生物传代快的优势,通过体外抗原抗体结合能力来筛选目标大分子;后者则是将人源抗体基因转入小鼠体内,间接实现了“免疫人”。
这两项技术终于把单抗的制备技术带到了华山之巅,整个生物制剂领域有了一次飞跃,特别是后者,最早一批实现转基因小鼠的Medarex为首个CTLA-4抑制剂和PD-1抑制剂铺平了道路。
这两种技术出发点都是实现全人源,不过各自的优缺点也是很明显。噬菌体展示技术基于大肠杆菌和噬菌体,生产速度是很快的——问题也出在这里,咱们知道蛋白不是光氨基酸序列对了就行,三维结构也很重要,而噬菌体对蛋白三维折叠的加工显然是不如真核细胞精细的,就算后来又发展出了酵母展示技术,也是没法和哺乳动物细胞比较。
另外,还记得咱们前面说过的B细胞的几个大杀器吗,这套全自动优化流程噬菌体展示技术是代替不了的,想要得到高亲和力的抗体,还需要进行更加漫长的筛选和人工改造。
 转基因小鼠技术的特点就与此完全相反了。相对来说,给小鼠建立免疫的过程会较长,但是抗体生成的大部分过程都是在体内进行的,只要抗原暴露充分,就能够得到亲和性足够高的抗体,就不需要繁琐的“手动”优化了,而且这些抗体从理论上来说跟人体产生的不会有很大差别。
转基因小鼠技术的特点就与此完全相反了。相对来说,给小鼠建立免疫的过程会较长,但是抗体生成的大部分过程都是在体内进行的,只要抗原暴露充分,就能够得到亲和性足够高的抗体,就不需要繁琐的“手动”优化了,而且这些抗体从理论上来说跟人体产生的不会有很大差别。
所以我们怎么知道一个单抗好不好?
其实在一个单抗应用在患者身上之前,我们已经能从其体外特征上大致看出它是否具有大展宏图的潜力了。
以PD-1抑制剂为例,首先要具有能与PD-1高亲和高特异性结合的可变区;其次功能上为了避免对靶细胞、也就是T细胞的毒性,应选用IgG4亚型;再次,IgG4抗体在体内会发生重链重组,S228P修饰能够避免这个问题让抗体结构更稳定;最后,单抗的制备方法、也就是单抗来源,一定程度上能够说明它可能具有的免疫原性。
在结构的基础上,单抗在临床前实验中表现出的亲和力、特异性、免疫原性、Fc段特征和功能性,这些就是我们评估单抗综合实力的数据指标了。
亲和性
抗体依赖与抗原的特异性结合发挥作用,最理想的情况肯定是每个抗体都能够百分百结合抗原,发挥最大效能。以一当百喜闻乐见,以百当一就有点说不过去了对不对。单抗的亲和力到底有多强,直接影响到了药物效果、临床的最佳剂量和部分副作用程度。
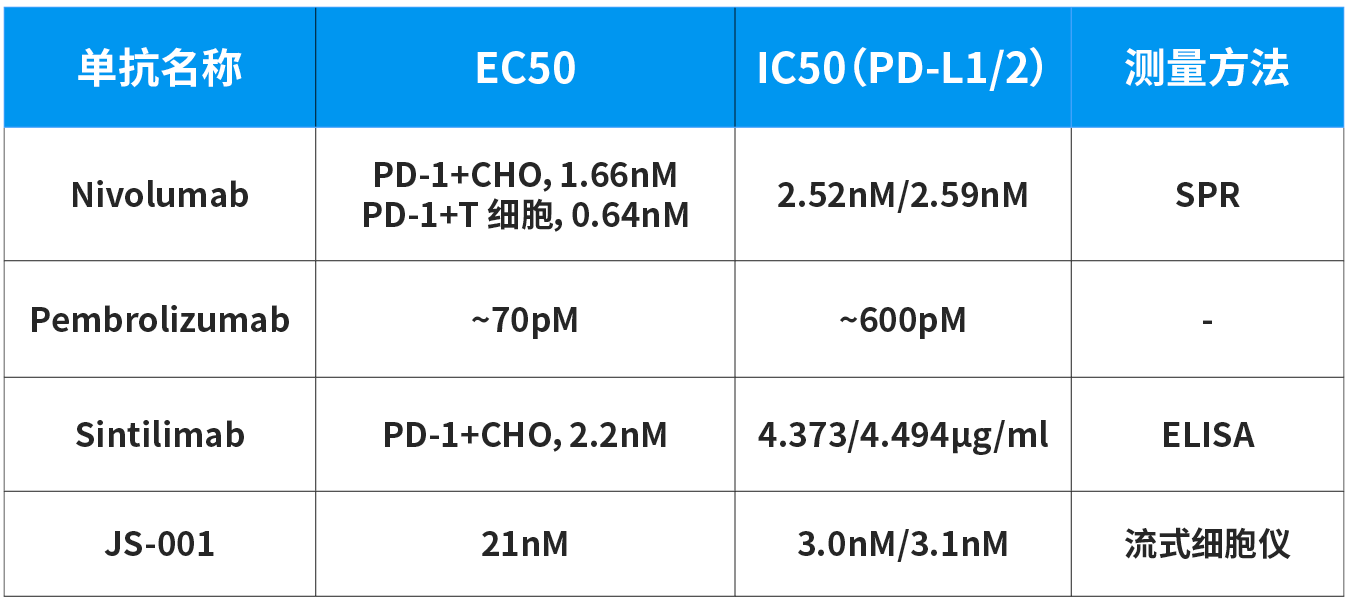
单抗的亲和力看的主要是两个指标,EC50和IC50。
EC50指的是半数效应浓度,指的是药物在引起50%最大效应变化时的浓度;IC50指的是半数抑制浓度,指的是某种抑制剂实现最大抑制效果50%时的浓度。在PD-1抑制剂这里呢,EC50和IC50关系到药物与PD-1的结合能力和抑制PD-1与PD-L1/2结合能力。
说得更通俗一些,这俩数值越小、抗体的亲和力越高,那么临床达标的最佳剂量就可能更低,副作用可能更小。
特异性
单抗药物最大的优点,就是当年Paul Ehrlich提到的“魔法子弹”,只针对标靶绝不误伤正常组织,一个让打谁就只打谁的单抗才是好单抗。这一点可以通过免疫组化分析,来确定抗体是否对正常组织“出手”。
 在今天涉及的四种药物中,只有nivolumab对于其特异性作了详细披露。原则上nivolumab特异性结合PD-1,不与其他免疫球蛋白超家族成员,例如CD28、CTLA-4等发生作用,研究者们通过免疫组化在多个人类组织中证实了这一点。从结果来看,包括心、肝、肺、肾、脾、小脑等在内的多个组织都未出现特异性染色,只有垂体在20倍抗体浓度下表现出了低免疫活性,不过该组织并未检出PD-1表达。
在今天涉及的四种药物中,只有nivolumab对于其特异性作了详细披露。原则上nivolumab特异性结合PD-1,不与其他免疫球蛋白超家族成员,例如CD28、CTLA-4等发生作用,研究者们通过免疫组化在多个人类组织中证实了这一点。从结果来看,包括心、肝、肺、肾、脾、小脑等在内的多个组织都未出现特异性染色,只有垂体在20倍抗体浓度下表现出了低免疫活性,不过该组织并未检出PD-1表达。
免疫原性
从某个角度来说,单抗本身也可以被免疫系统当作是一种抗原,具有免疫原性,免疫系统有可能会产生抗药物抗体(ADA)。这显然不是我们愿意看到的,一是ADA会加速单抗药物的清除,这意味着第一次使用有效的药量很可能第二次就不够用了,必须不断增加使用量或频次,直到最后完全没用;二是如果免疫原性过强,很容易激起机体的过度免疫反应,带来一系列副作用——可比打不过感冒病毒发烧流鼻涕严重多了。
 ADA也和我们体内的其他抗体一样分为好几类,其中对药效影响最大的就是中和抗体。
ADA也和我们体内的其他抗体一样分为好几类,其中对药效影响最大的就是中和抗体。
从临床数据来看,CA209066研究中107位患者中仅有6位(5.6%)患者出现ADA,其中未检测出中和抗体;综合6项临床研究的数据,也仅有0.3%的患者持续表现出ADA阳性。而且无论ADA还是中和抗体,它们的存在都与超敏反应、输注反应或药物失效无关,可以认为nivolumab在临床上是没有免疫原性的。
另一方面,pembrolizumab临床试验中1289名患者有26名(2.01%)出现ADA,这26位患者中有4位进行了中和抗体检测,显示1位中和抗体阳性。
Effectorfunction不过免疫原性在临床上受到药物本身、储存方法、患者条件、检测方法等多因素影响,这方面很难直接对比。
Fc段特征
对PD-1抑制剂来说,对Fc段的要求有些特别。大部分治疗性单抗的目的都是结合抗原抓住致病原,诱导免疫细胞杀敌,前者通过CDR的特异性识别实现,后者则是通过Fc段结合免疫细胞实现的。但是PD-1抑制剂不同的点在于,它结合的标靶PD-1是位于T细胞上的,但PD-1抑制剂可不是来消灭T细胞的。
于是,为了避免同类相残的惨剧,PD-1抑制剂的制备选用的大都是IgG4型抗体。这个亚型很温柔,其天然的抗体依赖的细胞毒性(ADCC)很弱,补体依赖的细胞毒性(CDC)也几乎没有,如果再加以一些修饰能够去除这两大项作用就更加完美了。是否有ADCC和CDC存在,也是衡量PD-1单抗效果的指标之一。
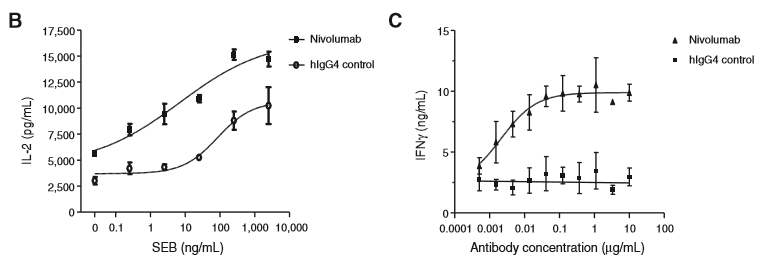
nivolumab可激活T细胞功能
Fc段特征在评价PD-1单抗方面还是很重要的,会直接影响到T细胞的工作效率or存亡与否。
功能性实验数据
PD-1抑制剂的最终目的是解放T细胞的潜能、让它去杀癌细胞。在这一点上,一方面IFN、IL等细胞因子的释放已经被证实与T细胞激活有关,另一方面,观察实验动物体内肿瘤的生长情况也是很好的选择。我们不妨对已披露数据一探究竟。
对健康供者细胞进行的实验证实,在有抗原刺激的条件下,低浓度的nivolumab就能够显著增加T细胞的增殖,并促进IFN-γ和IL-2的释放,同时并不会导致非特异性淋巴细胞的激活。
JS-001的功能实验显示其能有效刺激T细胞增殖和IFN-γ、TNF-α释放,同时还与nivolumab进行了横向比较。可见JS-001功能性与剂量相关性更大,较高剂量时细胞因子水平更高;而nivolumab的发挥更“稳定”,极低剂量也能达到一定效果。
功能性实验可以说是对前述体外特征的进一步验证。
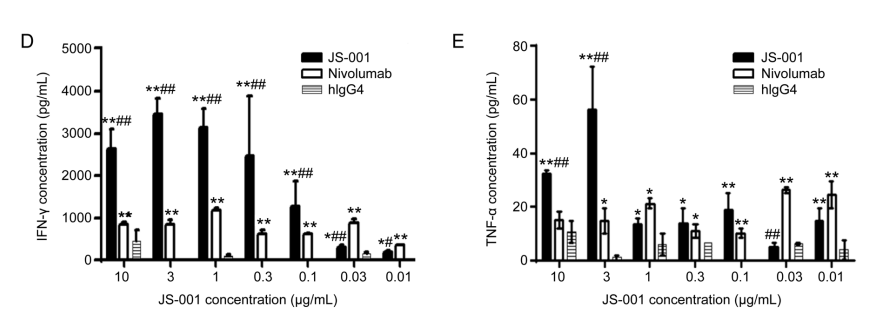
JS-001与nivolumab的横向对比
总的来说,单抗药物的结构设计是决定其功能效应的先决条件。面对一款PD-1单抗,我们只有把牢其最基本的评价原则——从亲和性、特异性、免疫原性、Fc段特征入手,结合其在功能性实验上的表现,才能初步判断它是否具有一飞冲天的潜力。
这些特征在临床上也是能被进一步证实的,比如nivolumab的临床数据显示,nivolumab与PD-1的结合似乎不依赖于剂量,首次用药后4-24小时即出现平均峰值85%,这与nivolumab在体外表现出的高亲和性是一致的。
追本溯源,回归原点。只有从最开始了解PD-1单抗的临床前特征,才能帮助我们真正慧眼识英雄。
参考资料:
[1] Agrawal S, Statkevich P, Bajaj G, et al. Evaluation of immunogenicity of nivolumab monotherapy and its clinical relevance in patients with metastatic solid tumors[J]. The Journal of Clinical Pharmacology, 2017, 57(3): 394-400.
[2] Longoria T C, Tewari K S. Evaluation of the pharmacokinetics and metabolism of pembrolizumab in the treatment of melanoma[J]. Expert opinion on drug metabolism & toxicology, 2016, 12(10): 1247-1253.
[3] Wang C, Thudium K B, Han M, et al. In vitro characterization of the anti-PD-1 antibody nivolumab, BMS-936558, and in vivo toxicology in non-human primates[J]. Cancer immunology research, 2014.
[4] Brahmer J R, Drake C G, Wollner I, et al. Phase I study of single-agent anti–programmed death-1 (MDX-1106) in refractory solid tumors: safety, clinical activity, pharmacodynamics, and immunologic correlates[J]. Journal of clinical oncology, 2010, 28(19): 3167.
[5] https://www.accessdata.fda.gov/drugsatfda_docs/nda/2014/125514Orig1s000PharmR.pdf
[6] Fessas P, Lee H, Ikemizu S, et al. A molecular and preclinical comparison of the PD-1–Targeted T-cell checkpoint inhibitors nivolumab and pembrolizumab[C]//Seminars in oncology. WB Saunders, 2017, 44(2): 136-140.
[7] Fessas P, Lee H, Ikemizu S, et al. A molecular and preclinical comparison of the PD-1–Targeted T-cell checkpoint inhibitors nivolumab and pembrolizumab[C]//Seminars in oncology. WB Saunders, 2017, 44(2): 136-140.
[8] Fu J, Wang F, Dong L, et al. Preclinical evaluation of the efficacy, pharmacokinetics and immunogenicity of JS-001, a programmed cell death protein-1 (PD-1) monoclonal antibody[J]. Acta Pharmacologica Sinica, 2017, 38(5): 710.
[9] Zhang S, Zhang M, Wu W, et al. Preclinical characterization of Sintilimab, a fully human anti-PD-1 therapeutic monoclonal antibody for cancer[J]. Antibody Therapeutics, 2018, 1(2): 45-53.
原标题:深度解密:PD-1战国时代,如何从单抗的结构和临床前药物特征,评价PD-1单抗的整体性能