异种移植技术成熟了吗?未来能否解决供体器官的短缺问题?
前言:国内唯一的低免疫原性再生医学材料及器官移植赛道的领军企业正在融资,平行线资本担任财务顾问,有兴趣请微信联系(ID:Jefferyau)。
微信原文:万字长文:基因编辑解决异种组织排斥难题,再生材料及器官移植赛道见证大变局时代?
一直以来,器官移植供体处于严重的“供不应求”状态。我国每年因终末期器官衰竭而苦苦等待器官移植的患者约有30万人,而器官捐献人数这几年不增反降,目前每年约5000人次,仅够完成器官移植手术19000例。另外根据美国器官获取和移植网络的数据,目前美国约有11.7万人正在等待移植器官,但2019年只有3.6万多人接受了器官移植。这种长期的器官等待让每年6000人左右美国人失去生命,2000多人因为等待时间过长而导致体质变差,不再适合进行器官移植,只能等待生命终点来临。
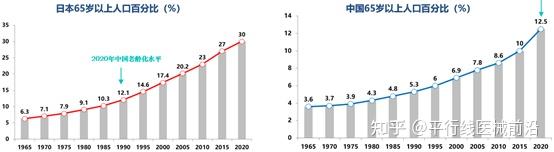

目前除了器官捐献率的长期低迷,在中国老龄化发展趋势确定后,各种随之而来的器官衰竭疾病,不但会使目前这种器官移植的困境无法缓解,甚至可能会雪上加霜。目前中国老龄化率为12%,目前只有日本的1/3,仅1990年日本老龄化水平,至少需要30年才能达到日本老龄化的当前水平(30%)。
因此,面对随时都可能失去生命的器官供体等待者,在同种供体稀缺的情况下,为他们找到合适供体的需求已经迫在眉睫。以医用猪器官移植为供体来源的异种器官移植或是解决这一问题的终极方法。

但是,异种器官的排斥问题始终是摆在异种器官移植面前的拦路虎。2012年,第三代基因编辑技术CRISPR/Cas9横空出世,为异种器官移植提供了革新性的解决方案。2012年8月17日,Jennifer Doudna和Emmanulle Charpentier合作,在《Science》杂志发表了基因编辑史上的里程碑论文,成功解析了CRISPR/Cas9基因编辑的工作原理。2013年2月15日,张锋在Science杂志发表了,首次将CRISPR/Cas9基因编辑技术应用于哺乳动物和人类细胞。
2015年,杨璐菡博士与美国三院院士George Church在《Science》发文,通过使用CRISPR/Cas9基因编辑技术成功抑制了猪内源性逆转录病毒(PERV)的基因表达,清除了猪内源性逆转录病毒这个最大的安全移植障碍。2018年,德国慕尼黑大学赖夏特研究团队在《Nature》杂志上发表文章,他们将经过基因改造猪的心脏移植到狒狒体内,接受移植后最长存活时间达六个半月。2020年9月21日,杨璐菡等在《Nature Biomedical Engineering》上发文,成功开发出第一代可异种器官移植雏形-“猪3.0”。在CRISPR/Cas9技术下,敲除3种异种多糖抗原表位基因GGTA1, CMAH和B4GALNT,另外转入9种人类基因hCD46, hCD55, hCD59, hB2M, HLA-E, hCD47,hTHBD, hTFPI 和hCD39,增强了猪与人之间免疫相容性和凝血相容性,为异种移植提供了更安全的保证。
2020年12月,异种器官移植迎来了新的进展,美国FDA批准了首个可以同时用于人类食物消费和作为潜在疗法来源的转基因猪上市。这是由United Therapeutics公司旗下Revivicor公司的一种经过基因改造的家猪——GalSafe猪,其细胞表面表达的α-半乳糖已被消除。2022年1月,美国马里兰大学Griffith团队进行了全球首例基因改造猪的心脏移植到人体的手术。接受手术的是一名57岁的男性心脏病人,他在手术后存活了约两个月。国内多位受访专家认为,“猪心移植” 是划时代的医学进步,虽然病人只活了两个月,但这是一个相当成功的案例,就像宇航员登月一样,这次事件是“病人的一小步,但是人类医学史上的一大步”。
2022年1月,美国阿拉巴马大学的Porrett团队和纽约大学的Montgomery团队分别将基因编辑猪的肾脏移植给了三位脑死亡患者,移植的异种肾脏均发挥了泌尿功能且没有发生排斥反应。2022年12月1日,中南大学湘雅三医院运用猪胰岛移植技术,成功诊治一位2型糖尿病肾移植术后3年合并移植肾损伤患者,目前患者已顺利出院。2022年6-7月,纽约大学脏移植外科主任纳德·莫阿扎米团队又成功地将两颗猪心移植到濒临死亡患者的体内。移植后,两位接受者体征稳定,心脏功能正常。2023年1月26日,德国慕尼黑大学医院著名心脏外科专家布鲁诺·赖夏特表示,人类移植猪心脏研究正处于“最后冲刺阶段”,估计两年可投入应用。
在CRISPR/Cas9基因编辑技术快速发展下,异种移植方面从2022年以来已经开始了数次临床尝试,而且不停地在创造着器官移植的历史,也在预示着不久的将来梦想即将照进现实,异种移植将是解决人类器官衰竭的终极武器。2023年,通过基因编辑异种供体提供Organs on Demand被评为麻省理工评论2023年十大突破性技术。


从器官移植费用来看,每位患者的手术费用约为30万元至40万元,而国内器官等待人群已经是数十万,而且随着老龄化的日趋严重,因此异种移植是一个千亿级的、未被满足的市场,在追求商业利益的同时还能挽救每年数十万人的生命,值得本土企业扎根入局这一蓝海领域。
器官移植赛道
eGenesis


eGenesis于2015年由哈佛大学George Church 院士和杨璐菡博士共同创立,总部位于马萨诸塞州,专注于基因编辑技术用于异种细胞和器官移植。
异种器官移植面临着两个主要的医学挑战:动物组织的免疫排斥和感染性疾病传播的风险,只有成功解决这两个挑战才能将异种器官移植推广应用。eGenesis在异种移植领域的开创性成果在2015年11月发表在Science,利用CRISPR基因编辑技术,敲除了猪基因组中可能有害的内源性逆转录病毒基因(PERVs),从而扫清了猪异种器官感染性疾病传播重大风险,也重新燃起了公众对异种器官移植的信心。


eGenesis目前正在开发的EGEN?平台也正是利用文中的基因编辑技术去解决了上述2个异体移植的历史性挑战。该平台技术主要包括以下三方面:
1,通过基因敲除灭活了猪基因组内的所有内源性逆转录病毒序列,防止病毒从猪传给人,并使用生物安全、无病原体的动物生产工艺来解决其他病毒传播的风险。,
2,利用多重基因编辑技术全面解决移植器官免疫介导排斥反应的多种机制。这些专有基因改变的目标是减少炎症,防止器官或细胞被人类免疫系统识别为外来物。
3,多重基因编辑允许同时进行多种精确的基因修饰。eGenesis的遗传有效载荷通过三种方式调整:基因插入、基因敲除和精确的基因整合。eGenesis使用位点定向集成技术,使遗传有效载荷通过利用允许高度控制的位点特异性插入到猪基因组中。
2020年5月20日,eGenesis收购了其重要的生产合作伙伴:ICBiotec,它是美国为数不多的拥有先进克隆技术和大型转基因动物生产能力的公司之一。对于eGenesis来说,收购ICBiotec将帮助其达成对异种器官供应链的全面控制。
2021年3月2日,eGenesis公司宣布完成1.25亿美元的C轮融资,这笔资金将用于推动肾脏移植和胰岛细胞移植进入人体临床试验,以及对现有基因编辑平台的持续开发和GMP生产规模的扩大。
2023年1月9日,eGenesis和Eledon Pharmaceuticals宣布达成一项合作研究协议,根据该协议,eGenesis将获得Eledon的抗CD40L抗体候选药物tegoprubart,用于eGenesis正在进行的用于治疗器官衰竭的人类相容器官和细胞的临床前研究和开发研究。这项合作有可能跨越多个基因工程项目,包括肾脏、心脏和胰岛细胞移植。
Micromatrix Medical


Miromatrix成立于2009年,源于明尼苏达大学在灌注脱细胞和再细胞化技术方面取得的突破性进展,总部设在明尼苏达州。Miromatrix正在引领用于移植的生物工程异种器官的开发,专注于创造可移植的肾脏 (mirokidney?) 和肝脏 (miroliverELAP?, miroliver?),并计划对肺、胰腺和心脏等其他重要器官进行生物工程改造。
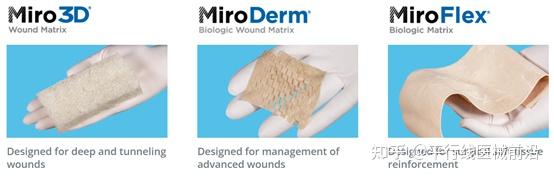
2019年,Miromatrix Medical分拆出来用于软组织加固的MiroFlex和用于高级伤口护理的MiroDerm等再生医学材料业务,成立Reprise Biomedical,专注于开发基于灌注脱细胞工艺的生物修复材料。因为伤口管理也是一个很有潜力的赛道。2023年1月,Reprise Biomedical融资1300万美元,也说明了资本对于脱细胞异种再生材料的认可。

传统的脱细胞方法是浸入式脱细胞,通过将组织或器官浸入化学和酶处理中来实现的。但是浸入式脱细胞仅限于有限的薄组织,因为该技术依赖于化学物质从外表面向内扩散,然后在细胞被移除后退出。而Miromatrix和Reprise采用的灌注脱细胞过程可以实现快速的整个器官脱细胞,克服了浸入脱细胞相关的障碍。这是通过对主要血管系统进行插管并通过天然血管灌注温和的洗涤剂溶液来实现的。由于器官富含血管系统,大多数细胞位于毛细血管附近,导致洗涤剂的有效表面积呈指数增加,并减少了通过静脉系统排出细胞物质的时间。


使用Miromatrix专有的灌注脱细胞工艺,从收获的猪器官供体中去除猪细胞,留下支架或细胞外基质(“ECM”),它保留了原始器官结构的结构、机械特性和血管网络。据估计,猪ECM与人ECM的同源性超过93%,这显著降低了抗体形成和不良排斥反应的可能性。然后,人类细胞被引入到基质中,以组织工程再细胞化的方式制造一个新的人源化异种器官。再细胞化是用功能性人体细胞填充器官的过程,是整个人源化器官的关键部分。Miromatrix目前使用从捐赠的人体器官中分离出的活体人体细胞来重新植入细胞外基质,并在未来打算开发使用患者来源的干细胞的新技术。活的人体细胞具有适应性,当引入脱细胞ECM 时,会显示出独特的再生、可塑性和粘附特性。再细胞化过程发生在生物反应器中,其中培养基和活的人类细胞以适当的顺序灌注到ECM中,以促进细胞再生和器官功能。一旦再细胞化异种器官优化完成,可以使用现有的移植技术和设备将人源化器官植入患者体内。
平行线医械前沿
Miromatrix的脱细胞技术得到广泛的临床前和动物研究的支持。Miromatrix与梅奥诊所合作进行的一项临床前研究表明,当将生物工程肝脏植入患有ALF的猪体内时,该生物工程肝脏保持着可检测的健康状态,并在移植后表现出早期肝功能。2022年11月,一次性生物工程肝脏疗法miroliverELAP向FDA提交了新药临床试验申请(IND),成为首个生物工程器官的IND。2023年2月1日,Miromatrix Medical宣布与百特(Baxter)合作,进一步开发该生物工程器官的临床价值,双方将合作开发治疗急性肝衰竭(ALF)患者的独特疗法。双方将结合Miromatrix的一次性生物工程肝脏和百特旨在为患者提供个性化治疗的PrisMax系统。如果临床试验进展顺利,Micromatrix的生物工程肝脏将在患者体外与百特的PrisMax系统连接,为患者提供外部支持。
Revivicor


当年世界上第一个克隆羊多莉诞生后,科学家希望把克隆技术进行产业转化,于是在美国弗吉尼亚成立了PPL Therapeutics。公司致力于让克隆的羊产生人体所需要的蛋白,例如产出“人奶”。但这事被当地的动物保护组织知道后,该公司遭受了极大的舆论压力,不得不关停。2003年,PPL Therapeutics分拆出Revivicor,专注于异种移植器官的研究。


2011年,United Therapeutics收购Revivicor,进入器官移植领域。该公司将克隆猪的肺提供给需要肺移植的患者。目前,Revivicor公司是世界上最大的基因工程克隆猪公司。
2020年,Revivicor首次获得FDA的批准,将GalSafe?猪用作人类食用的食物来源和潜在人类治疗药物的来源。GalSafe猪中alpha-gal基因在供体猪中被“敲除”,这种基因产生一种被称为α-gal的糖。已有研究表明异种α-半乳糖基抗原(α-Gal)是异种器官移植超急性免疫排斥反应中的主要靶抗原。α-Gal是含有聚乳糖胺核心,末端残基含有细胞表面分泌型糖蛋白或糖脂,广泛存在于猪、牛、马等低等哺乳动物体内。人体、类人猿、旧世纪猴的半乳糖苷转移酶基因有2个碱基错位变异而不表达Gal抗原,但人类血清中存在高滴度的抗α-Gal抗体(占总血清球蛋白的1%~3%),而当人体接受含有Gal抗原的异种器官移植或生物材料植入时会导致超急性或慢性的免疫排斥反应。
平行线医械前沿
α-半乳糖综合征(AGS,又名α-半乳糖过敏、红肉过敏或蜱虫叮咬肉类过敏)是指在食用红肉类(如猪肉,牛肉和羊肉)或接触其他动物性食品和产品后发生的对α-Gal的迟发性过敏反应。因此GalSafe猪对于喜爱红肉类又有AGS过敏的人群来说是特大好消息。尽管GalSafe的猪排和香肠馅饼尚未上市,但Revivicor已开始向马里兰州夏洛特霍尔的Amber Shifflett等患有AGS并花了数月时间避免食用红肉的人发送免费样品。
一些不含α-gal的猪的再生医学材料产品还可以用于AGS患者以外的地方。例如,心脏瓣膜越来越多地来源于牛和猪。但是由于免疫攻击,这些生物瓣膜会恶化,必须在10到15年后更换。为了减缓这种攻击,动物源性瓣膜被进行脱细胞处理,并进行化学处理以掩盖免疫刺激残留物。但根据杜克大学的儿科心脏外科医生Joseph Turek的说法,α-gal在“实际上相当惊人”的水平上仍然可以检测到,正如他在4月份的《Thoracic and Cardiovascular Surgery》上所报告的那样。据他估计,不含α-gal的瓣膜使用寿命可能是其他生物瓣膜的两倍。
目前为止,移植手术的开展主要局限于猪的供给和监管障碍。目前只有Revivicor公司等为数不多的公司拥有适当的设备和达到临床等级的猪。
2021年12月31日,美国FDA通过“同情使用”条款,授予大卫·贝内特实验性手术的“紧急授权”。术中使用到的猪心供体,就来自Revivicor公司。随后美国马里兰大学医学中心执行了这次世界瞩目且具有里程碑意义的全球首例基因编辑猪心异种移植手术。
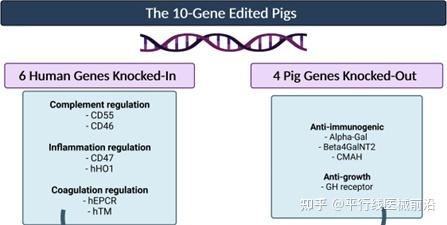
为了获得这次移植手术的猪心脏,Revivicor编辑了猪基因组中的10个基因,克服了排异反应,使器官适合移植给人类患者。Revivicor公司敲除了猪的3个基因(Alpha-Gal,Beta4GalNT2,CMAH),这些基因会诱导来自人体免疫系统的攻击;插入了6个人类基因(hCD55,hCD46,hCD47,hH01,hEPCR,hTM),防止移植器官中的排斥、炎症和血凝块形成;另外1个基因(GH receptor)被沉默以限制移植后的器官生长,确保来自动物的器官能保持在人类器官的大小。

另外,2022年在脑死亡患者身上的多例异种移植亚临床试验均采用了Revivicor的基因编辑猪。其中包括2022年1月,美国阿拉巴马大学的Porrett团队和纽约大学的Montgomery团队分别将基因编辑猪的肾脏移植给了三位脑死亡DBD患者,移植的异种肾脏均发挥了泌尿功能且没有发生排斥反应;2022年6-7月,纽约大学脏移植外科主任纳德·莫阿扎米团队又成功地将两颗猪心移植到脑死亡DBD患者的体内。移植后,两位接受者体征稳定,心脏功能正常。
Alexis Bio


Alexis Bio(前身为Xeno Therapeutics)成立于2018年,总部位于Grantham,New Hampshire。2022年12月,Alexis Bio的异种皮肤产品-realSKIN?是第一个被美国FDA指定为再生医学先进疗法 (RMAT) 的活细胞异种移植产品,也是第一个完成I/2期临床试验的治疗性异种皮肤移植。
在所有患者中,自体移植时,Xeno-Skin和人类皮肤比较仪无法区分。所有患者样本的术后RT-PCR评估显示没有检测到猪内源性逆转录病毒的证据。在积极的1/2期数据的支持下,RMAT指定给予了申办者更早和更多的与FDA的互动,包括关于产品是否有资格获得优先审查或加速批准的讨论。目前正在准备3期临床,评估realSKIN ?的安全性、耐受性和有效性。
“我们很高兴 FDA确定 realSKIN ?符合RMAT指定的标准,因为这提供了优先审查和/或加速批准的可能性,”首席执行官Paul W. Holzer 说。“这提供了比原计划更快地为患者提供急需的治疗选择的潜力。”
RMAT指定允许更早和更多地与FDA互动,包括根据可能合理预测长期临床益处的替代或中间终点讨论优先审查和/或加速批准是否合适;或依赖从大量站点获得的数据。一旦获得批准,在适当的时候,FDA可以要求做出各种批准后承诺。
烧伤患者在创伤的急性阶段需立即接受治疗。因为严重烧伤后由于皮肤屏障被破坏,导致感染,免疫受损以及液体流失。如果不得到治疗可能导致电解质、体温和pH值失衡,最终导致器官衰竭和死亡。目前,对烧伤的标准临床治疗方法是使用从死去人体上获取的皮肤进行移植,然而这种皮肤组织的来源非常有限。
Alexis Bio的解决方案是使用非人类皮肤来进行移植。Xeno-Skin是通过基因工程敲除a-gal后,从不携带病原体的猪身上获取的皮肤组织,这种异体皮肤包含表皮和真皮组织,含有具有生物活性的猪细胞。这种异体皮肤组织的优势在于可以被大量生产,经过消毒处理后可以冰冻冷藏,在需要皮肤移植手术的时候快速运送到各地即时使用。基因工程猪仍由Revivicor提供。
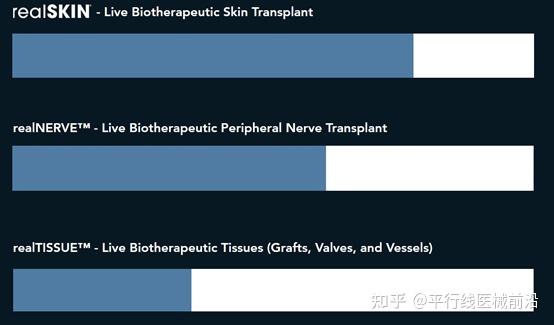

Alexis Bio的其他产品包括:realNERVE ?-一种新型活体生物治疗性神经移植方法。;realTISSUE涉及更多再生医学材料产品,包括细胞、骨移植物、血管、瓣膜 和结缔组织。
Makana Therapeutics


Makana Therapeutics成立于2009年,是异种移植领域的全球领导者,专注于开发异种抗原敲除的基因工程猪。
2020年10月,Recombinetics Inc宣布与Makana Therapeutics合并,Makana Therapeutics 将成为 Recombinetics Inc. 的最新子公司,并将专门致力于解决器官短缺危机。Recombinetics是一家领先的基因编辑公司,在治疗学开发方面拥有平台技术,主要布局三个业务领域:
Surrogen:建立基因编辑的人类疾病动物模型。这一块主要是加速新药研发。把实验动物身上的疾病相似基因也行突变,使得实验动物和人一样得病。这样医药公司就可以对实验动物进行医药研发。
Regenevida:人造器官移植。把猪身上的胰腺进行基因突变,而后移植到病人身上。
Acceligen:精准育种。通过改造动物基因,使得水产等食用动物更健康、更高产。
“Recombinetics Inc. 在猪基因组工程方面的深厚专业知识非常适合Makana 的异种移植专业知识,”即将卸任的 Makana Therapeutics 总裁兼首席执行官 Catherine Thut认为。“通过提供丰富的供体器官来源,我们可以共同加速完成改变器官衰竭患者生活的使命。”
Makana? Therapeutics的主要产品是Triple Knockout Pig,简称TKO pig。它是猪中三个异种抗原基因敲除(GGTA1, CMAH和B4GALNT)的组合,可有效伪装来自人类受体免疫系统的跨物种移植物。Triple Knockout Pig 是在迈阿密移植研究所医学博士Joe Tector的实验室中发现的,他也是Makana 的创始人。“三重基因敲除猪从根本上改变了异种移植领域,”普拉特说。“这种动物的器官已被证明与超过30%的等待肾脏移植的患者匹配,并且可能超过70%的患者可以通过可用的移植前治疗从这些器官中受益。”
Makana在异种移植方面取得了令人信服的成果。“TKO猪,结合我们在免疫抑制和患者匹配方面的进步,在异种移植领域产生了最长和最一致的临床前存活数据,”Makana 总裁兼首席执行官马克普拉特在新闻发布会上声称。“我们现在正集中精力从肾移植开始在临床上取得成功。”
Makana正在与美国FDA就下一步进行首次肾移植人体临床试验进行谈判。试验将在迈阿密大学进行。
再生材料
生物医用材料是主要应用于医学领域对生物机体进行治疗、修复或替换其病损组织、器官或增进其功能的一类材料。最早的生物再生材料主要是缺损组织的替代,大部分是在物理层面,如传统的骨科植入物、颌面填充物等。区别于传统的生物医用材料,生物再生材料通常具备诱导组织再生的功能,将材料植入人体,可诱导或加速缺损组织或器官生长。比如具备生物功能的再生组织,能够促进组织生长的支架、生物补片等。
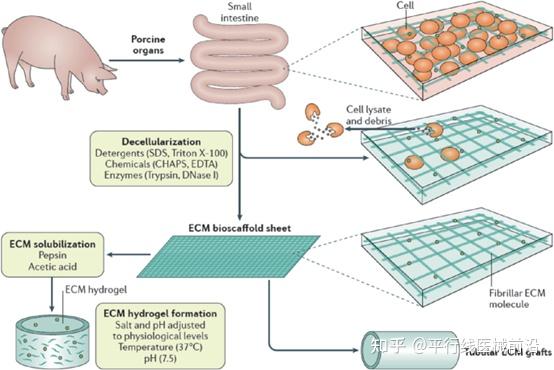

来自于同种异体的生物材料是使用最广泛的一类生物材料,但是因为其来源不稳定且量较少,无法满足大规模生产的需求。以动物源为主的异种生物材料则弥补了这方面的不足,近年来迅速发展。目前已应用于:(1)植入材料,如异种皮质骨、人工骨、骨修复材料、骨填充材料;(2)心脏或组织修补材料,如牛或猪心包生物瓣膜、心脏补片;(3)眼科植入材料,如异种角膜(猪源)、结膜、眼内充填材料等;(4)人工器官,如人工皮肤、异体脱细胞真皮;(5)医用生物敷料;(6)可吸收性止血、防黏连材料,如生物蛋白胶、医用胶原膜、透明质酸;(7)医用缝合材料,如医用可吸收胶原缝合线、羊肠线等。
目前大部分应用的异种生物材料均为脱细胞基质材料。主要是经过不同脱细胞方法加工,去除组织中含有的各种细胞、抗原成分,完整保留了富含胶原的立体纤维框架,可供宿主细胞增殖、组织重塑和血管再生。不同的脱细胞方法包括物理方法(切割、震荡、超声、高压、冻融)、化学方法(Triton X-100、SDS、酸/碱)和酶学方法(胰蛋白酶、Dispase、核酸酶)。常用的异种组织类型为真皮,小肠黏膜下层-SIS,角膜,心包等。
在众多脱细胞基质材料中,脱细胞生物补片目前在诸多领域得以发挥其修复作用。与人工合成材料补片的组织修复机制完全不同,其植入机体后会,诱导血管内皮细胞增生,基质快速再血管化,循环中的干细胞进入受损组织,引导组织进行“内源性组织再生(intrisic tissue regeneration)”;干细胞在目标区域的细胞外基质中分化为组织特异的细胞类型,最后重新产生新的细胞外基质,完成组织修复和重建。这种内源性组织再生过程更接近于生理状态下生命组织的自然修复过程,修复后的组织无瘢痕组织,无高分子异物存留在体内而发生的慢性炎症。
在腹壁疝手术中,若手术创面存在污染或潜在感染的情况下,往往不能应用以聚丙烯为代表的人工合成补片作为修补材料;而生物补片比人工合成补片具有更好的生物组织相容性,耐受感染的能力更强,并体现出可以快速血管化、较少粘连等特性。但是目前生物补片行腹股沟疝手术后发生血清肿液体集聚是最常见的并发症,发生率在7%~15%之间,提示病人体内存在较为显著的植入后炎性反应。尽管动物源性生物材料在制备过程中经过了脱细胞和去除抗原的处理,但残留的异种抗原(α-Gal epitope)仍存在着导致慢性免疫毒性反应的风险。
因此,α-Gal抗原的完全去除将成为动物源性生物材料大规模应用的基础条件,降低免疫排斥反应和慢性免疫毒性反应。而敲除α-Gal的基因工程猪将会是理想的生物再生材料的制造工厂。
目前在替代或修复治疗人体组织病变上,生产制造动物源性异种生物材料的产品也已列为国家重点扶植的生物医药领域的高新技术产业,市场前景广阔。
1)以伤口修复材料为例:中国烧伤年发病率约为1.5%-2%,每年遭遇意外伤害人群中,烧伤仅次于交通事故,排在第二位,而且在交通事故伤害中有大量合并烧伤伤员。烧(创)伤等多种原因造成皮肤大面积缺损后,可导致人体严重的屏障功能障碍,甚至危及生命。我国每年因烧(烫)伤和外伤、创伤、糖尿病伤口等而需要进行植皮手术的人约有500多万人,目前修复皮肤缺损最有效的方法是自体皮肤移植,但自体皮常因大面积烧(创)伤等供体严重不足,且切取自体皮对患者本身也是一种创伤。因此,用猪的皮肤作材料,去除免疫原性,灭活病毒,制成人工皮肤,用于伤口修复,市场前景巨大。
2)以腹股沟疝修复为例:根据我国的流行病学调查,腹股沟疝的发病率最高,占整个疝发病数的90%。腹股沟疝的发病率在3‰-5‰,而在60岁以上人群中的患病率可高达1%-5%。在中国疝病患者人数每年可达300-500万。目前手术是根治疝病的惟一可靠方法,据不完全统计,全球每年有超过2000万例的疝修复手术。
3)角膜市场:中国角膜盲患者超500万人,每年新增超10万,但每年捐献来源的角膜供体仅5000-9000例,供体严重短缺。另外,老龄人口比例不断攀升,老年人的角膜病更容易出现视力缺陷和角膜盲,相关患者数量群体不断扩大,也使得角膜移植的需求日益迫切。预计板层移植角膜手术市场规模可达100亿,全层移植角膜市场为数百亿,整体来看,生物眼角膜整体市场空间巨大。
角膜从结构上可分为五层:上皮细胞层、Bowman层、基质层、Descemet膜和内皮细胞层。传统角膜移植手术方式主要包括穿透性角膜移植(penetrating keratoplasty;PK;全五层替换)、前板层角膜移植(Deep Anterior Lamellar Keratoplasty; DALK;前三层替换)和后弹力层剥离自动化内皮角膜移植术(Descemet Stripping Automated Endothelial Keratoplasty;DSAEK;后三层替换)
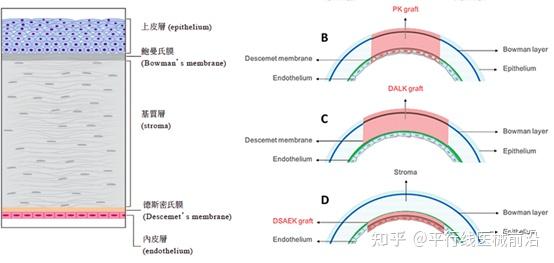

目前同种异体角膜捐献不足,人工角膜假体材料相容性及术后并发症高发,因此组织工程来源的角膜供体成为最佳选择。国内生物角膜主要来源是猪角膜,但是由于猪角膜的脱细胞角膜不具备角膜上皮、内皮的特征,不能进行穿透性角膜移植手术,只应用于板层角膜修补,规模最大的全层角膜损伤的患者的需求仍得不到满足。
生物角膜产品原始状态都是脱水无色透明的,缝合到患者眼球以后,会经历一个蛋白质吸水后的水肿过程,所以会变成乳白色,之后受体患者内皮细胞层能够将生物角膜中的水分吸走,吸走之后,生物角膜会逐渐恢复原来的无色透明状态。而能否脱盲,关键就在于这一个环节。目前由于异种蛋白和宿主免疫系统冲突,再浑浊发生率较高,脱盲率不够满意。由于异体排斥和脱盲率等问题,现在应用市场也受到压制。
但是随着基因编辑猪技术的发展,从初步的a-gal排斥基因敲除到最后多个排斥基因敲除技术的发展,最终实现无需脱细胞技术来解决免疫排斥的生物角膜也是未来发展的趋势,为全层角膜损失患者提供生物角膜的根本性解决方案。
4)胶原蛋白市场:胶原蛋白赛道从2022年开始由于合成生物学概念的兴起,又着实火了一把。胶原蛋白在抗衰老美容填充、功能性护肤品和医用创面敷料等领域广泛应用。目前重组和动物源性胶原蛋白市场规模分别为108亿元、179亿元,并且有持续上涨的空间。据弗若斯特沙利文预测,至2027年,重组和动物源性胶原蛋白市场规模分别有望达1083亿元、655亿元,2022年至2027年的CAGR为25%左右。
虽然重组胶原蛋白在免疫原性控制和放大生产方面都有显著的优势,但是目前的发酵工艺技术也未完善,成本相对较高;另外发酵工程中用的大肠杆菌和酵母菌缺乏脯氨酸羟化酶,故无法生成羟脯氨酸,而羟脯氨酸的羟基正是胶原蛋白形成稳定三螺旋结构的关键,因此重组胶原蛋白一般没有天然胶原蛋白那种完整的三螺旋结构,其生物活性存在疑问,同时也决定了其相关功能无法媲美动物源胶原蛋白,如结构支撑性,促进胶原再生能力等等。
据估计3%~5%的人对胶原蛋白存在过敏反应,所以使用前2~4周必须做皮肤测试。若患者1年前做过胶原蛋白注射,且没有出现并发症,仍然建议做单剂量测试。在解决免疫原性方面,动物源胶原蛋白的免疫原及病毒风险规避可以通过控制原料来源。以双美生物为例,公司使用二代SPF猪(Specific Pathogen-Free,无特定病源),凭借SPF动物严苛的养殖条件以减小动物源病毒风险。
每一类生物材料都可以解决人类因意外受伤,手术缺损,器官衰竭等导致的机体失能的众多问题,都对应着数十亿至数百亿的生物机体修复市场。因此如果能提供仅次于人体自身组织的生物再生材料,还能解决人体组织永远无法解决的大规模的材料供应问题,这才是生物再生材料的最终发展趋势。
下面就是具体一些生物再生材料的应用场景:
心脏补片/瓣膜
动物源的生物再生材料已经在心脏疾病手术中发挥他们的价值。在传统的外科心脏手术中,心脏补片可以用于心脏房间隔、室间隔缺损等心脏外科修复手术。目前北京普惠医疗、常熟金仕生物和北京佰仁医疗均有获批心脏外科生物补片。其中佰仁思?心外科生物补片是国内首个获批的牛心包心外科补片,产品适用范围广泛,是唯一批准可应用于心外科房间隔、室间隔、主动脉根部、右室流出道、瓣环、心肌和心包修复的外科修补材料。临床应用超过17年,累计植入超过50万片,积累了大量循证医学证据,是被大组、长期临床应用证实的成熟产品。也是目前国内唯一可广泛用于心脏修补的动物源性植入产品,最大程度满足临床医生对生物修复材料的需要。
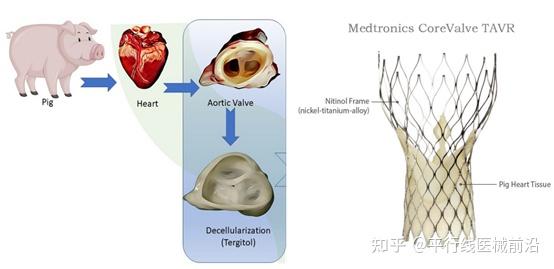

另外在介入瓣膜置换赛道,动物源的心脏瓣膜市场也是在临床上应用多年,包括美敦力CoreValve /启明医疗Venus-A/苏州杰成-J-Valve在内的众多厂商也是采用的猪心包。
随着经导管植入的心脏生物瓣膜的适用人群正在由早期的高龄患者扩大至中低风险年轻患者,因而对瓣膜耐久性提出了更高的要求。传统的基于牛或者猪心包的生物瓣膜在临床应用过程中暴露出钙化、微血栓的形成、免疫原性的个体差异以及手动缝制的繁琐性等弊端,也限制着产品的临床实际寿命。
泌尿系统植入物:


尿道狭窄是泌尿外科常见疾病,被定义为尿道腔在海绵体区域的异常狭窄。狭窄是缺血性海绵体纤维化的结果,表现为海绵体中的疤痕组织。长期后果是皮肤慢性造瘘、复发性败血症、膀胱结石、梗阻性尿路病、梗阻性肾病以及最终肾衰竭。近年来随着腔内操作的广泛开展,医源性尿道狭窄逐渐增加。目前可用于尿道狭窄修复的外科技术需要从自体部位,比如口腔黏膜,获取移植物,导致组织获取部位并发症的额外风险和患者的额外疼痛。Regenosca正在开发生物工程胶原蛋白植入物可以作为口腔黏膜的替代生物材料,用于尿道狭窄患者的尿道成形术。
Regenosca的技术来源于EPFL的Frey教授和Hubbell教授的实验室。这家初创公司由Mattias Larsson(首席执行官)、Eva-Maria Balet(首席运营官)和 Kalitha Pinnagoda(负责临床事务)于2019年创立。


Regenosca 拥有获得专利的植入技术平台,可以制造用于软组织修复的再生和机体友好型植入物。概念验证在一项正在进行的首次人体研究中得到验证,在该研究中,Regenosca的植入物成功用于修复尿道狭窄。目前尿道狭窄修复的金标准是使用患者自己的口腔内组织。第二个手术部位会产生额外的疼痛,增加并发症的风险,并延长整个手术时间。Regenosca的现成和即用型植入物将使泌尿道重建和食道修复等手术干预的侵入性降低,并填补缺失生物材料的空白。
平行线医械前沿
Regenosca目前还在开发膀胱生物补片,改善膀胱重建后患者的生活质量。该植入物可用于先天性膀胱畸形或患有神经源性膀胱的儿童,被诊断患有间质性膀胱炎、神经源性膀胱或膀胱顺应性/容量改变的成年人需要进行膀胱手术以避免危及生命的肾脏损伤。
压力性尿失禁(SUI)是指在咳嗽、大笑等腹部压力增加时而膀胱逼尿肌未收缩的情况下出现的不自主溢尿。SUI在中年女性中的发病率为10%~40%,明显影响女性的身心健康。
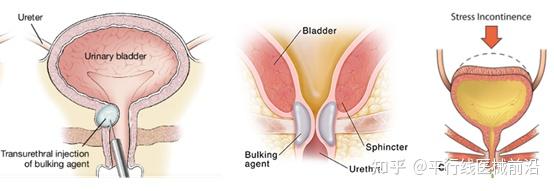

尿道膨胀的作用机制是通过增强或恢复正常粘膜接合。填充剂被注入粘膜下空间以抬高尿道粘膜,从而增加接合和尿道阻力。理想的填充剂应该易于注射、具有成本效益、生物相容性、非迁移性,并且很少或不会引起组织炎症。已经开发了许多用于尿道膨胀的药物,但没有一种是理想的。许多药物已经被引入市场,并且由于临床考虑或市场原因而被去除。
常见的填充剂包括胶原蛋白和含有各种试剂的水基凝胶。通过膀胱镜或特殊设计的注射器将膨胀剂注射到膀胱颈正下方的尿道周围。这种手术不需要在阴道或腹部进行切口、切割或缝合。
骨科植入物


Tecnoss成立于1998年,总部位于意大利Giaveno。OsteoBiol?是Tecnoss?为牙科和颌面外科医生专门提供来自于猪的骨科生物材料品牌。在每个OsteoBiol? 颗粒中,除了其矿物相外,Tecnoss?工艺还保留了具有宝贵生物学特性的异种胶原相,使其具有生物相容性,是移植和增强目的的理想选择。OsteoBiol?胶原蛋白骨基质避免了高温工艺,避免了陶瓷化,保持了与自体骨极其相似的化学成分,因此可以逐渐被新形成的骨骼吸收和替换。
自体骨逐渐被新形成的骨所取代:同样,OsteoBiol?骨基质允许进行性破骨细胞吸收,同时新骨沉积。细胞从新形成的血管中获取营养,这些血管能够充分地在移植部位定植。新骨在 OsteoBiol? 颗粒内部和周围生长,在重新进入时,这些新骨部分但显着地被重要的骨骼取代。


胶原蛋白有利于MSC分化并增强成骨细胞增殖:它被认为是骨形成细胞的理想基质。OsteoBiol?双相颗粒骨代用品含有约22%的胶原蛋白。
OsteoBiol?不仅是一种胶原化骨基质:它是一个完整的生物材料家族,专为牙科领域的骨和软组织增强而设计。针对每一种临床适应症,都开发了专用产品,目标是提供最佳处理、理想的粒度和一致性,并最终在足够的再进入时间内获得最佳的再生结果。
目前美国新泽西的Regenity Biosciences(原Collagen Matrix)也是一家异种再生材料公司,其产品也包括含有胶原蛋白的骨传导骨矿物质 牙周、口腔和颌面外科骨移植用复合材料。具体是由来自猪松质骨的无机骨矿物质颗粒组成压缩、甲醛交联、以及预成型的猪跟腱胶原蛋白混合,已经FDA获批。
胶原半月板植入物


Ivy Sports Medicine成立于2011年,专注于研发微创半月板修复假体,拥有市场上唯一获得FDA认证的胶原半月板植入物Collagen Meniscus Implant-CMI?。其是由I类胶原组成的基于吸收性高纯度胶原的外科网片,旨在促进半月板的自愈过程,多用于半月板内侧撕裂或组织受损的患者。
当患者的半月板受损严重以致无法缝合时,通常会被认定为无法修复,不得不进行手术切除。研究表明,半月板切除会增加软骨受力,导致退行性病变。这会导致患者在运动时受到极大疼痛,最终只得置换人工膝关节。而CMI?的开发就是为了防止或缓解半月板切除导致的长期不良后果。在临床层面,CMI?已被证实为安全可行的半月板治疗方案。通过植入CMI?这种三维生物相容性结构,半月板受损部位将会依靠人体自身组织再生进行修复。
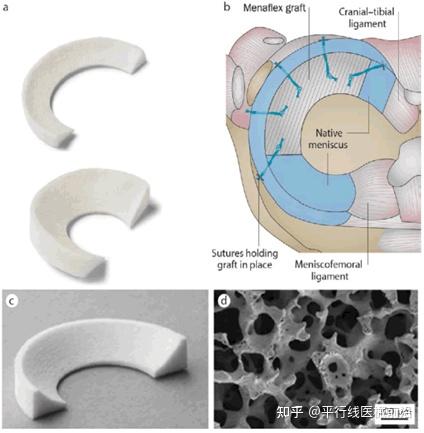

2016年9月,全球著名骨科企业史赛克Styker宣布收购Ivy Sports Medicine公司,此次收购使得史赛克能够为客户提供全面的半月板修复技术,更好的为患者服务。
“收购Ivy Sports Medicine加强了本部门的综合实力,并且符合公司当前的投资战略。其全面的半月板修复技术有着丰富的临床经验,能够为我们的客户提供多种解决方案。” 史赛克运动医学部门总经理Matt Moreau评价此次收购,“半月板修复是一个非常有潜力的运动医学领域,Ivy Sports medicine提供了一个独有的技术,使我们能更加深入地研究关于半月板修复的治疗方案。”
肌腱/肩袖损伤


Embody成立于2015年,总部位于弗吉尼亚,是一家专注于修复肌腱、韧带和肩袖撕裂的胶原蛋白植入物开发商。2023年1月,Zimmer Biomet宣布将收购Embody来构建其运动医学产品组合。这笔骨科交易包括1.55亿美元的预付款,如果 Embody 的产品在收购后的三年内获得新的监管批准并明确具体的销售里程碑,则额外支付高达1.2 亿美元。
Embody的两大产品为TAPESTRY以及TAPESTRY RC。TAPESTRY是第一个FDA获批的高度排列的基于胶原蛋白的肌腱修复植入物,可逐渐吸收,留下新的肌腱样组织以增强现有肌腱,用于足部和踝关节肌腱手术、前交叉韧带撕裂和髋关节臀中肌修复。其特点包括细胞友好的微结构、具有定制的纤维直径和特定的孔隙率/空隙率。TAPESTRY的孔隙率经过精心设计,可形成50至300μm之间的一致孔径。体内完全吸收的TAPESTRY植入物展示了在植入物周围和代替植入物的致密胶原结缔组织的形成。


2022年5月,Embody宣布其TAPESTRY?RC System已收到FDA的510k许可,用于治疗肩袖损伤疾病。TAPESTRY?RC System专为关节镜手术而设计,将生物整合性胶原蛋白TAPESTRY植入物的愈合优势、流线型输送以及完全生物可吸收的固定锚结合起来,设计用于微创关节镜手术以覆盖部分和全部撕裂,生物可吸收贴片和锚固件将植入物固定在患者的肌腱和骨骼上,以帮助随着时间的推移促进愈合,同时留下基于胶原蛋白的结缔组织。TAPESTRY RC系统的新颖设计结合了预装了TAPESTRY生物整合胶原蛋白植入物的关节镜导入器和FDA批准的首个完全生物可吸收的固定锚,用于易于使用的预加载锚钉插入器中固定肌腱和骨骼。
平行线医械前沿
“我们相信 TAPESTRY RC为关节镜肩袖手术树立了新标准,”Embody 首席执行官Jeff Conroy告诉媒体。“基于TAPESTRY的临床实用性,现在是一种用于关节镜肩袖手术的简化的一体化解决方案。”
Northwell Health骨科研究所高级副总裁兼执行主任、Northwell Health骨科外科主席兼教授Nicholas Sgaglione医学博士说:“临床上仍然需要进一步提高肩袖疾病治疗的治愈率。”“Embody的TAPESTRY RC系统允许在完全生物可吸收的解决方案中进行高效和多功能的输送,以在关节镜手术中对肩袖进行生物增强。”
“历史上的重点是肌腱和韧带的机械修复,而不是生物增强,”圣卢克康沃尔医院运动医学主任Wasik Ashraf博士说。“TAPESTRY使我能够利用生物刺激性胶原蛋白的力量来改善患者的康复,现在是解决肩袖疾病的快速简便的解决方案。”
另外一家骨科公司Smith and Nephew也开发了类似的胶原蛋白基植入物-REGENETEN?Bioinductive Implant,治疗大面积严重的肩部撕裂。
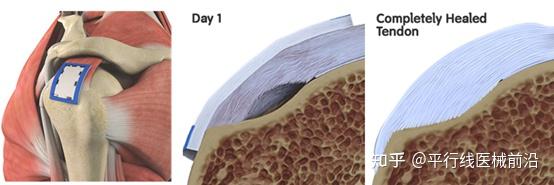

REGENETEN生物诱导植入物是一种创新的微创解决方案,超越了传统手术,通过诱导新的肌腱组织生长来帮助肌腱愈合。胶原蛋白材料取自高纯度牛跟腱,后经特殊加工制成具有高孔隙率低弹性模量的生物材料。
结语
中国几十万以及全世界几百万的器官移植等待人群已经等不及自愿捐献的少数器官供体,他们随时都可能有生命的危险,而异种器官移植在当下来看已经是最可行的解决方案。在解决异种组织排斥方面,目前大部分脱细胞的再生医学材料已经在临床上获批,也给少数病人带来受益,但仍然还存在残留异种抗原等问题造成未能进行大规模应用,而敲除异种排斥基因的猪则将成为最为合适的再生医学材料工厂,并从根本上解决异种排斥问题,让异种再生材料得以高安全性的大规模推广应用。在器官移植方面,目前以Miromatrix为主的异种脱细胞后人源化器官路线走在临床的最前面,已经开始着手临床试验;另外以基因编辑路线的异种移植在2022年取得诸多进步和突破,在更多的亚临床经验积累之下,应该在临床进度方面将快速赶超脱细胞人源化器官路线,因为脱细胞的彻底性、人源化细胞的培养和分化以及多种人源细胞的再生分布与功能化都将存在技术上的挑战。
后记:国内专注于呼吸介入肺减容赛道的领军企业正在融资,平行线资本担任财务顾问,有兴趣请联系。呼吸介入蓝海赛道信息,请参考万字长文:心血管介入赛道极其内卷,呼吸介入是下一片蓝海吗?
欢迎大家积极留言发表自己的看法,或加本人微信(ID:Jefferyau)探讨,建有生物医疗行业最新动态分享交流微信群,可通过加本人微信入群。本文版权归本公众号(ID:PXX-Medical)所有,欢迎联系转载。