前瞻生物医药产业全球周报2021第18期:生物医药界再添21名院士,强生未来4年



生物医药界21人!两院院士「增选名单」公布
11月18日,科技界迎来盛事,备受瞩目的2021两院院士增选结果出炉,共149人当选:包括中国科学院增选院士65人、中国工程院增选院士84人。其中,21人来自生物医药界:中国工程院11人,中国科学院10人。
未来4年有望递交14款潜在重磅新药上市申请 强生展现研发蓝图
11月20日,强生公司的高管在投资者会议上详细介绍了该公司的医药研发策略和重点项目。强生旗下杨森公司的全球研发负责人Mathai Mammen博士指出,截至2025年,强生有望递交16款创新疗法或疫苗的监管申请,其中14款创新疗法具有成为重磅药物的潜力。

国内
强强联合,恒瑞和精翰团队成功开发基于流式细胞术
近日,从精翰生物生物分析实验室传来好消息,经过3个多月的努力。恒瑞医药和精翰生物项目团队,成功开发出基于流式细胞术检测pERK磷酸化蛋白的方法,该方法将作为重要的PD指标支持恒瑞医药SHP2抑制剂的临床开发。
恒瑞医药与基石药业13亿元战略合作 引进CS1002
11月21日,基石药业与恒瑞医药联合宣布,双方就抗CTLA-4单抗CS1002达成大中华地区的战略合作及独占许可协议。根据协议,恒瑞医药将支付基石药业总计最高约2亿美元的首付款和里程碑付款,基石药业授予恒瑞医药针对抗CTLA-4单克隆抗体CS1002在大中华地区研发、注册、生产和商业化的独占权利,许可用途为所有人类和动物疾病。
Teri Loxam担任科越医药首席运营官兼首席财务官
11月19日,科越医药宣布任命Teri Loxam为首席运营官(COO)和首席财务官(CFO)。Loxam将接管临时首席财务官Matt Gorman的财务工作,还将负责领导公司战略和运营职能部门。
《以临床价值为导向的抗肿瘤药物临床研发指导原则》正式发布
11月19日,CDE官网连发6条通知/通告,涉及到原料药、流感疫苗临床研究、抗肿瘤药物临床研究、吸入制剂、参比目录等。《指导原则》中提出“新药研发应以为患者提供更优的治疗选择作为更高目标”,明确指出了“‘对照药’是体现新药临床价值的基础”,“应该关注阳性对照药是否反映和代表了临床实践中目标患者的最佳治疗选择”。
和铂医药和科伦博泰多项全人源抗体偶联药物研发全速推进
11月18日,和铂医药与科伦博泰召开研发交流会议,就多项达成全球战略合作的项目展开讨论。多年来,和铂医药与科伦博泰建立了紧密的合作关系,通过整合两家公司在技术、科学研究和临床方面的特长和资源, 在双方共同感兴趣的国际领先创新项目上持续发力,加速抗体新药在中国和全球范围的研发进程。
近岸蛋白质与沃森生物签订mRNA疫苗原料战略合作协议
11月17日,苏州近岸蛋白质科技股份有限公司与云南沃森生物技术股份有限公司(的控股子公司玉溪沃森生物技术有限公司在玉溪举行了战略合作签约仪式,双方就沃森生物mRNA疫苗项目原料酶的供应达成深度战略合作。未来,近岸蛋白质将积极推进上游原料供应链建设,为沃森生物的国内首个 mRNA疫苗实现产业化奠定坚固的基础。
阿斯利康架构调整
11月15日,阿斯利康中国正式向员工宣布,部分业务架构进行调整,主要变化在两大核心板块:及县业务和心血管及代谢、肾脏业务。此次将及县业务拆分,及县肿瘤业务并入肿瘤事业部,非肿瘤业务独立,成为及县慢病业务部;将心血管及代谢事业部、肾脏业务部合并,成立心血管、肾脏及代谢事业部。
国际
FTD新药!武田行使选择权开发脑渗透颗粒体蛋白替代疗法DNL593
近日,Denali Therapeutics公司宣布,其合作伙伴武田制药已根据2家公司之间的现有合作协议行使了选择权,共同开发和商业化DNL593。这是一种脑渗透颗粒体蛋白前体替代疗法,用于治疗携带颗粒体蛋白突变的额颞叶痴呆。
新冠药物MP0420最新研究失败 Molecular Partners股价下跌32%
11月16日,Molecular Partners公司宣布,因Acv-3临床研究中对MP0420进行的无效性分析未达到继续纳入住院治疗新冠肺炎患者的门槛,提前终止该部分研究。此消息一出,Molecular Partners公司股价下跌32%。Acv-3临床研究作为加速新冠肺炎预防治疗和疫苗计划的一部分,由美国国立卫生研究院开展,旨在评估多种在研新冠药物的安全性和有效性。
又一家PD-1出海!丽珠与Bright Peak达成海外授权合作
11月15日,美国Bright Peak Therapeutics公司对外宣布,丽珠集团控股子公司丽珠单抗与美国Bright Peak Therapeutics签订研究合作和授权许可协议,丽珠单抗将具有自主知识产权的注射用重组人源化抗PD-1单克隆抗体有偿非独家许可给BPTx用于开发新型PD-1靶向免疫细胞因子,并向BPTx授权 LZM009用于除大中华地区以外的地域开发及商业化PD-1 ICs药物。

长效中和抗体展示预防新冠潜力
11月19日,阿斯利康(AstraZeneca)公司宣布了其长效新冠病毒中和抗体AZD7442,在预防和治疗COVID-19的两项3期临床试验中的最新结果。试验结果显示,一针肌肉注射AZD7442,在随访时间为6个月时,将患上出现症状的COVID-19的风险降低83%。
康乃德生物医药IL-4 Rα单抗CBP-201治疗特应性皮炎2期试验成功
近日,该公司公布了评估CBP-201皮下注射给药(SC)治疗中度至重度特应性皮炎(AD)成人患者全球2期临床试验(NCT04444752)的阳性顶线结果。数据显示,该试验达到了主要疗效终点:从基线到治疗第16周,湿疹面积和严重程度指数(EASI)评分的百分比下降在统计学上有显著改善。该试验中,CBP-201具有良好的安全性。
针对EGFR-TKI耐药!信迪利单抗+贝伐+化疗疗法III期结果出炉
11月19日,欧洲肿瘤内科学会亚洲年会的全体会议上,陆舜教授报告了ORIENT-31研究的首次期中分析结果。这是全球首个证实PD-1免疫联合疗法能够显著延长EGFR-TKI治疗进展的EGFR突变晚期非鳞状NSCLC无进展生存期的前瞻性、双盲、多中心III期研究。
康方生物多款双抗最新研究成果在SITC 2021上发布!
11月15日,康方生物宣布,在2021年11月10日-14日举办的第36届肿瘤免疫治疗学会年会上,公布了多项关于PD-1/VEGF双抗,和PD-1/CTLA-4双抗凯得宁单抗的最新研究成果。AK112是康方生物自主研发,全球行业内首个进入临床研究的PD-1/VEGF双特异性抗体。
针对子宫内膜癌 正大天晴PD-L1/TGFβ双抗进入II期临床
11月15日,Insight数据库显示,正大天晴在ClinicalTrials.gov登记了一项II期临床,评估TQB2858联合安罗替尼用于治疗复发或转移性晚期子宫内膜癌。这是这款PD-L1/TGFβ药物首次进入II期临床。
道尔生物首款新药报临床 靶向CLDN18.2
11月16日,CDE官网显示,道尔生物创新CLDN18.2抗体DR30303首次申报临床。DR30303是基于HTS-VHH Body技术平台筛选的特异性识别CLDN18.2的单域抗体和人源Fc融合获得的抗体药物,通过改造增强了基于ADCC和CDC对CLDN18.2阳性肿瘤细胞的杀伤效应,临床拟用于治疗胃癌、胰腺癌等高表达CLDN18.2的实体瘤。
首个阿尔茨海默病疫苗进入临床试验
11月16日消息,布莱根妇女医院宣布将启动一项1期临床试验,以评估一种新型鼻腔疫苗在预防和减缓阿尔茨海默病进展中的安全性和有效性。
百时美施贵宝终止研发NASH药物pegbelfermin
日前,有消息显示,百时美施贵宝正在终止中期资产NASH药物pegbelfermin的研发。在获得FALCON 2b期研究结果后,百时美施贵宝已决定停止继续开发该疗法,该疗法以前曾被称为BMS-986036。
Cell:类似于Delta变体的SARS-CoV-2变体可加剧新冠大流行
在一项新的研究中,来自美国哈佛大学陈曾熙公共卫生学院的研究人员构建出一种数学模型,发现具有与Delta变体相似特征的SARS-CoV-2变体---增强了传播性和感染以前感染/接种过疫苗的人的能力---将引起更严重的大流行病,与单独具有这两种特征之一的SARS-CoV-2变体相比,导致更多的感染和突破性感染/再感染。
拔火罐就能接种疫苗 科学家“古法今用”将递送效率提高近100倍
近日,有研究者开发了一种新型接种疫苗的方式——用类似拔火罐的方法通过皮肤直接递送DNA,并将递送效率提高了近100倍,该研究以“Novel suction-based in vivo cutaneous DNA transfection platform”为题发表在了《Science Advances》上。
科学家发现三阴性乳腺癌亚群患者的特殊代谢脆弱性
近日,一篇发表在国际杂志Communications Biology上的研究报告中,来自波士顿大学医学院等机构的科学家们通过研究在三阴性乳腺癌患者机体中识别出了一种特殊的代谢酶类和通路,其或有望作为一种特殊的生物标志物来帮助选择患者接受靶向性的疗法。

美国FDA允许18岁以上成人接种新冠增强疫苗
11月20日,美国FDA宣布,扩展Moderna和辉瑞/BioNTech新冠疫苗的紧急使用授权,允许18岁以上的成人接种新冠增强疫苗,这一授权大幅度扩展了可以接种增强疫苗的人群。这一授权是基于FDA对这两款mRNA疫苗作为增强疫苗的临床试验结果。对受试者免疫反应的评估显示,在接种增强疫苗约30天后,受试者的抗体反应得到显著增强。
君实生物JS012注射液获得药物临床试验批准通知书
11月19日,君实生物发布公告称,公司JS012注射液的临床试验申请获得批准,用于治疗晚期恶性实体瘤。JS012注射液的活性成分为重组人源化抗Claudin18.2单克隆抗体,可靶向作用于Claudin18.2靶点,抑制相关信号通路,通过激活抗体依赖细胞介导的细胞毒性及补体依赖的细胞毒性杀伤肿瘤细胞,拟用于治疗晚期恶性肿瘤,例如胃癌及胰腺癌等。
德琪医药塞利尼索治疗非霍奇金淋巴瘤在中国获批I/II期临床
11月19日,德琪医药宣布,中国国家药品监督管理局已批准塞利尼索联合来那度胺和利妥昔单抗治疗复发/难治性弥漫性大B细胞淋巴瘤和复发/难治性惰性非霍奇金淋巴瘤的剂量探索和安全性的单臂I/II期研究。
康泰生物口服五价重配轮状病毒减毒活疫苗获批临床
11月17日,康泰生物发布公告称,其和全资子公司民海生物研发的口服五价重配轮状病毒减毒活疫苗近日获得NMPA出具的《药物临床试验批准通知书》。该疫苗用于预防6周龄及以上婴幼儿感染轮状病毒导致的婴幼儿腹泻病。
抗CD40L抗体在华递交临床申请 治疗系统性红斑狼疮
11月18日,中国国家药品监督管理局药品审评中心(CDE)最新公示,优时比(UCB)公司已在中国递交注射用dapirolizumab pegol单抗的临床试验申请。公开资料显示,这是一款研究性抗CD40配体(CD40L)聚乙二醇化Fab片段,拟开发用于治疗系统性红斑狼疮(SLE),目前已在全球进入3期临床研究阶段。
欧盟已经批准两款新冠单克隆抗体药物上市
近日,欧洲医药管理局(EMA)宣布,欧盟已经批准两款新冠单克隆抗体药物上市,分别是罗氏和再生元联合开发的Ronapreve、韩国Celltrion公司开发的Regkirona。这两款中和抗体作为新冠病毒的治疗方法,对于免疫能力低下的患者,也能够提供有效的治疗。
首款IL-5单抗!葛兰素史克美泊利珠单抗注射液在华获批上市
11月19日,国家药监局药品批准证明文件待领取信息显示,葛兰素史克美泊利珠单抗注射液已在中国获批上市。美泊利珠单抗是一款“first-in-class”抗IL-5人源化单克隆抗体,也是全球首个获批的抗IL-5单抗。该药本次申请适用于嗜酸性肉芽肿性多血管炎成人患者治疗。
百济神州/百奥泰贝伐珠单抗生物类似药普贝希®在华获批上市
11月19日,百济神州与百奥泰共同宣布,中国国家药品监督管理局已正式批准普贝希®(贝伐珠单抗注射液)用于治疗晚期、转移性或复发性非小细胞肺癌和转移性结直肠癌患者。根据百济神州与百奥泰于2020年8月达成的合作协议,百济神州将进行普贝希®在中国市场的开发和商业化。
科伦药业控股子公司泰特利单抗注射液上市申请获NMPA受理
11月19日,科伦药业发布公告称,其控股子公司科伦博泰开发的泰特利单抗注射液提交的上市许可申请获得国家药品监督管理局药品审评中心注册受理,用于治疗既往接受过二线及以上化疗失败的复发或转移性鼻咽癌患者。
罗氏贝伐珠单抗两项新适应症在华获批
国家药监局官网显示,罗氏贝伐珠单抗注射液新适应症获得批准,据推测,两项适应症可能为联合卡铂和紫杉醇用于晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌患者的一线治疗以及联合紫杉醇和顺铂或紫杉醇和托泊替康用于持续性、复发性或转移性宫颈癌患者的治疗。
欧盟批准葛兰素史克美泊利单抗3个新适应症
葛兰素史克近日宣布,欧盟委员会已批准抗炎药Nucala,该药是一种特异性靶向抑制白细胞介素5的单克隆抗体,用于治疗3种嗜酸性粒细胞驱动的疾病:高嗜酸性粒细胞综合征、慢性鼻-鼻窦炎伴鼻息肉、嗜酸粒细胞性肉芽肿性多血管炎。
君实生物特瑞普利单抗治疗食管癌获FDA孤儿药资格认定
15日,君实生物宣布,其抗PD-1单抗药物特瑞普利单抗用于治疗食管癌获得FDA授予的孤儿药资格认定。这是特瑞普利单抗获得的第四个孤儿药资格认定,此前特瑞普利单抗治疗黏膜黑色素瘤、鼻咽癌及软组织肉瘤已分别获得FDA孤儿药资格认定。
勃林格殷格翰IL-36R单抗申报上市,治疗罕见银屑病
11月18日,CDE官网显示,勃林格殷格翰IL-36R单抗司柏索利单抗注射液上市申请已获NMPA受理。用于治疗泛发性脓疱型银屑病。
mRNA癌症疫苗获得FDA快速通道资格 治疗黑色素瘤
11月19日,BioNTech公司宣布,美国FDA已授予BNT111快速通道资格。BNT111是一款治疗性mRNA癌症疫苗。它能够编码4种在90%以上黑色素瘤患者中出现的肿瘤相关抗原,通过与PD-1抑制剂联用,防止T细胞耗竭,提高晚期黑色素瘤患者的预后。
Novavax和SII在菲申请紧急使用授权
11月19日,Novavax与SII宣布,菲律宾食品和药物管理局(FDA)已针对基于Matrix-M™佐剂的重组纳米颗粒蛋白新冠肺炎疫苗向Novavax授予紧急使用授权(EUA)。该疫苗将由SII以COVOVAX™品牌在菲进行制造和上市销售。
吉利德Hepcludex在美国申请上市
11月20日,吉利德科学近日宣布,已向美国食品药品监督管理局提交了Hepcludex的生物制品许可申请,该药是一种潜在首创的抗病毒药物,用于伴有代偿性肝病的成人患者治疗慢性丁型肝炎病毒感染。如果获批,Hepcludex将成为美国第一个治疗伴代偿性肝病成人患者HDV感染的药物方案。

阿斯利康三季度净亏16.52亿美元
日前,阿斯利康发布2021年第三季度财报。报告显示,阿斯利康第三季度营收为98.66亿美元,同比增长50%;净利润为-16.52亿美元,上年同期为盈利6.51亿美元;三季度业绩不及预期。中国区也成了第三季度阿斯利康全球唯一一个业务增速没能达到两位数的地区。

创始人为药明生物原副总裁 橙帆医药宣布完成五千万美元融资
11月15日,橙帆医药宣布完成五千万美元的天使轮融资,此次募集资金将用于橙帆医药上海研发中心的建立,创新药物发现与开发的平台搭建和产品管线的推动。橙帆医药由原药明生物高级副总裁李竞博士创建。
诺华出售罗氏股权所得207亿美元或用于收购Alnylam
这家位于美国马萨诸塞州剑桥的生物技术公司是诺华新收购的胆固醇药物Leqvio背后的RNA干扰技术的开发商,该药物预计将很快获得美国FDA的批准决定。此前,诺和诺德宣布斥资33亿美元购买临床阶段的RNAi生物技术Dicerna Pharma。几个月前,诺华公司董事长Joerg Reinhardt曾表示,该公司也正在积极考虑进军热门的mRNA领域。

安旭生物正式登陆科创板,IPO发行价格为78.28元/股
11月18日,杭州安旭生物科技股份有限公司在上海证券交易所正式登陆科创板,IPO发行价格为78.28元/股,公开发行1533.34万股新股,总计募集资金12亿人民币。
北海康成通过港交所上市聆讯
11月18日,据港交所文件显示,专注于罕见病用药的北海康成通过港交所上市聆讯,摩根士丹利和杰富瑞为其联席保荐人。北海康成成立于2012年,是立足中国、专注于罕见病的生物医药公司,致力于研究、开发及商业化生物科技疗法。
百利天恒药业科创板IPO 按第四套标准 拟募资14亿元
11月17日,百利天恒药业向科创板递交的IPO申请已获受理,公司招股书首次公开。百利天恒符合并适用科创板上市规则第2.1.2条第(四)项规定的上市标准:预计市值不低于人民币30亿元,且最近一年营业收入不低于人民币3亿元。百利天恒本次公开发行不超过4010万股人民币普通股,计划募集14.22亿元。
百济神州科创板IPO获证监会同意 拟募资超200亿元
11月16日,中国证监会发布公告称,按法定程序同意百济神州有限公司在科创板首次公开发行股票注册。这标志着百济神州登陆国内A股市场正式进入倒计时,全球首家在纳斯达克、港交所与上交所三地上市的生物科技企业即将诞生。根据此前百济神州招股书显示,此次拟募集资金223.45亿元。
诺唯赞敲钟上市,市值超300亿元
11月15日,南京诺唯赞生物科技股份有限公司在科创板敲钟上市,股票简称为诺唯赞,股票代码为688105。开市后,市值超过300亿元。公开资料显示,诺唯赞是一家围绕酶、抗原、抗体等功能性蛋白及高分子有机材料进行技术研发和产品开发的生物科技企业。

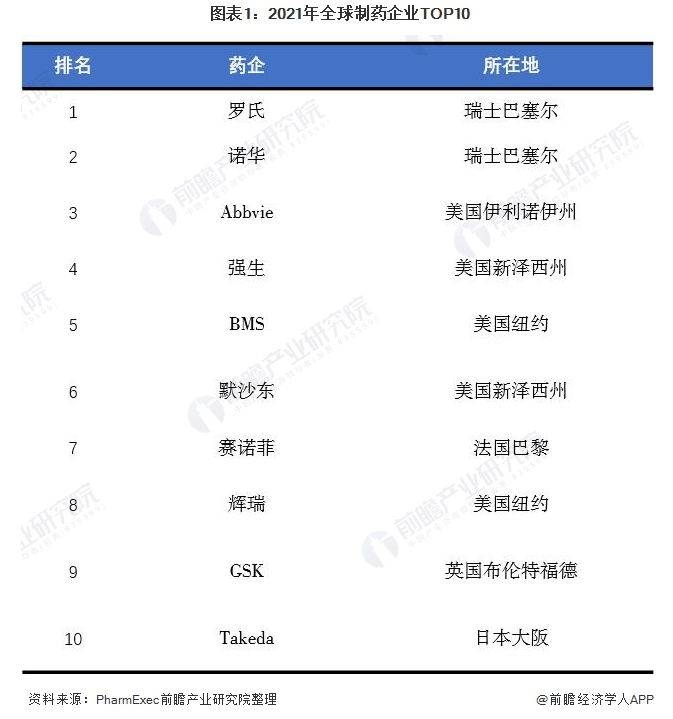
全球生物医药竞争格局:罗氏和诺华为全球龙头企业
罗氏和诺华是全球生物医药龙头企业。依据2021年6月22日,PharmExec(美国制药经理人杂志)公布的“2021年全球制药企业TOP50榜单”,罗氏和诺华是全球排名前二的两家制药企业。罗氏分别在瑞士的巴塞尔、美国的纳特利和帕罗阿托等地设有大型科研中心,其科学家曾经三次获得诺贝尔生理学奖。诺华是全球医药健康行业的跨国企业,世界三大药企之一。
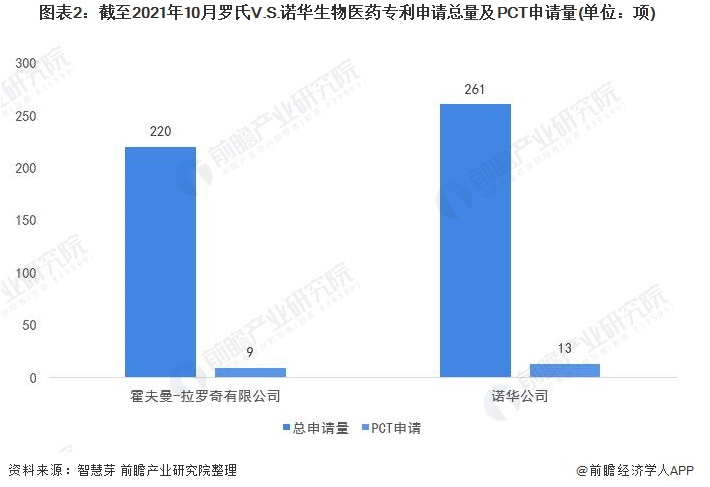
罗氏V.S.诺华生物专利申请量及PCT申请量对比:罗氏稍逊一筹
在生物医药专利申请量方面,罗氏和诺华差距较小。具体来看,截至2021年10月,罗氏和诺华的生物医药专利总申请量分别为220项和261项,诺华以41项的优势取胜。
此外,诺华生物医药PCT专利申请量也较罗氏生物医药PCT专利申请量多。罗氏和诺华的PCT申请量分别为9项和13项。

从学术到产业,更多定制化产业周刊(全球产业舆情监测、前沿技术情报追踪、产融政策权威解读、产业招商精准线索),敬请拨打400-068-7188。同时前瞻产业研究院提供产业研究、产业咨询、产业大数据、IPO募投可研、招股说明书撰写等解决方案。