新冠检测试剂申请EU Common List最新解析!
在COVID-19 大流行的背景下, HSC (Health Security Committee)于 2021 年 5 月成立了一个关于 COVID-19 诊断测试的技术工作组,旨在审查欧盟国家COVID-19生产商及需要纳入欧盟快速抗原检测通用清单的生产商的提案。
2021年7月6日,技术工作组发布欧盟通用清单仅包括样本类型为鼻、口咽或鼻咽的快速抗原检测试剂,欧盟通用清单应不包括快速抗原自检试剂。欧盟通用清单中包含的所有快速抗原检测产生的阴性检测结果可用于签发欧盟数字 COVID 证书。
截至 2021 年 7 月,技术工作组还审查了欧盟国家COVID-19生产商及需要纳入欧盟基于实验室的抗原检测通用清单的生产商的提案,2021年9月21日针对这些提案的评估标准得以统一。
那么,EU common list要如何申请及需要满足怎样的条件呢?请见IVDEAR团队如下解读。
欧盟快速抗原检测通用清单申请
01申请条件
1)需要至少一个欧盟成员国流通使用并已由至少一个欧盟成员国认证过的快速抗原检测试剂;
2)欧盟通用清单适用基于鼻、口咽或鼻咽采样类型的抗原检测试剂;
3)基于唾液、痰液、血液和/或粪便等其他采样类型的快速抗原检测不包括在欧盟通用抗原检测清单中。
02申请资料
1)EC Declaration of Conformity;
2)Instruction for Use;
3)Clinical Performance Evaluation Data:
方式一: 前瞻性临床研究: 至少100例阳性300例阴性样本,总灵敏度≥80%, 或者单独未预选样本试验中,CT≤25的灵敏度在90%以上,特异性≥98%;
方式二:回顾性临床研究:可用参考品测试,总灵敏度≥80%,或CT<25的灵敏度在90%以上, 参考品需要50个临床样本池构成,SARS-CoV-2 浓度范围大约为 1.1 x 109 to 4.2 x 102 copies/ml,Ct 值在 17至36之间,所占比例为:Ct value 17-25: about 40%;Ct value 25-30: about 40%; Ct value 30-36: about 20%;且每个池最多由10个鼻咽/口咽临床样本构成)。
Tips重点注意从2022年6月1日起,欧盟通用清单将分为两类:
A类:基于前瞻性临床研究的快速抗原检测试剂
B类:基于回顾性临床研究的快速抗原检测试剂
虽然 A 类和 B 类列表中快速抗原检测试剂都有资格颁发欧盟数字 COVID 证书,但欧盟官方将强烈鼓励成员国使用A 类列表中的试剂,这也意味着新冠检测试剂的前瞻性临床实验研究将可能是大势所趋,建议各企业重点关注和开展前瞻性临床实验研究。

03申请流程
1)抗原检测试剂需要先进入JRC COVID-19 In Vitro Diagnostic Devices and Test Methods Database数据库;
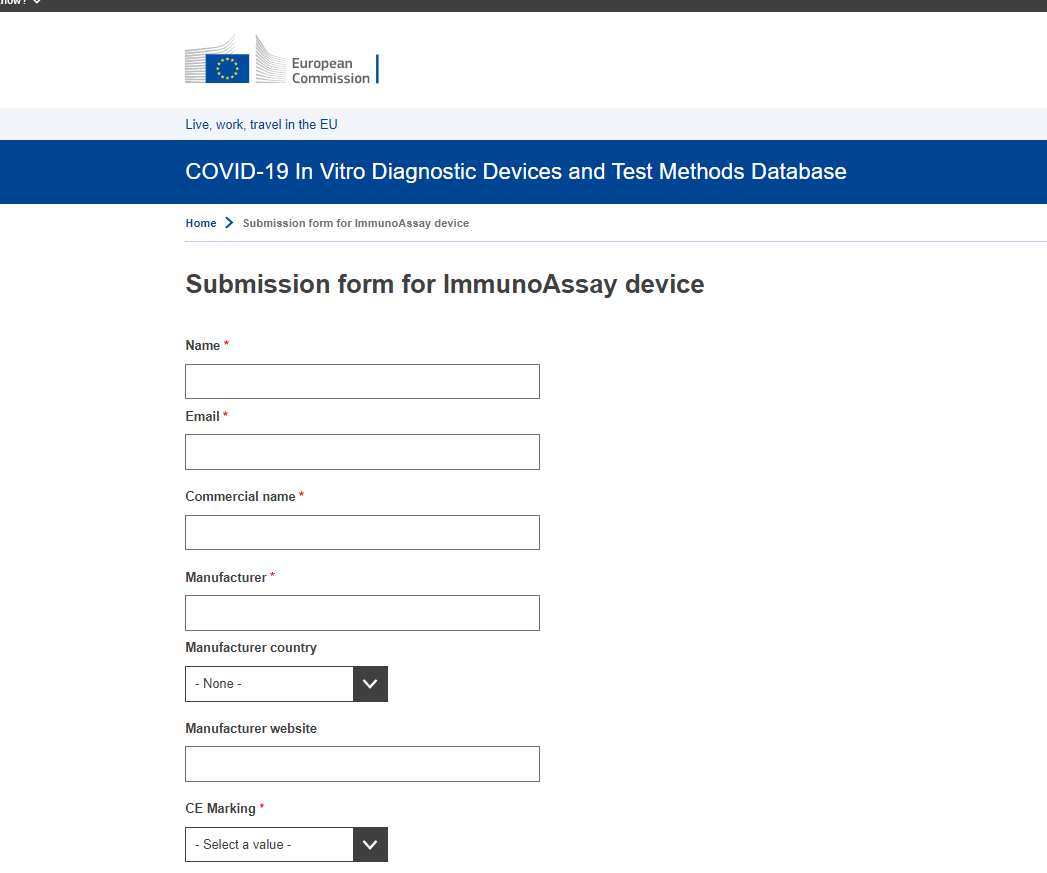
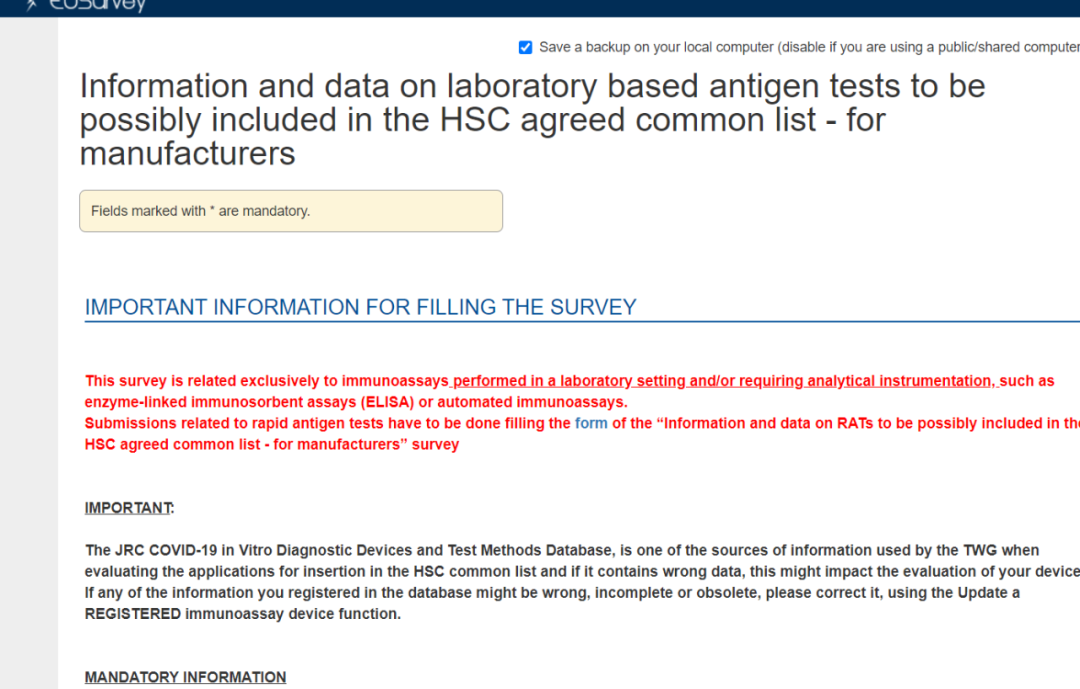
2)抗原检测试剂进入 COVID-19 In Vitro Diagnostic Devices and Test Methods Database后, 获得ID,然后根据要求填写EU common list survey for RATs;

Note: 如未获得 CE 标志、欧盟成员国验证和/或欧盟成员国使用,则该申请将不会转发给技术工作组进行审查。
3)进入技术工作组审核阶段,可根据网站信息查询审核进(一般是4周更新一次数据)。
欧盟基于实验室的抗原检测通用清单申请
申请条件和申请资料基本一致,根据用于审查快速抗原检测的相同标准进行审查。申请流程也是要先将产品进入到JRC COVID-19 In Vitro Diagnostic Devices and Test Methods Database数据库,获得ID,然后进入基于实验室的抗原检测通用清单survey。
总结
综上, 申请EU Common List 难度最大的部分在于临床实验研究,尤其是前瞻性临床。IVDEAR(国瑞中安集团子公司)可为各企业提供Common List申请的全过程服务、临床解决方案及临床性能评估技术咨询服务(包含前瞻性临床研究及回顾性临床研究),如您有相关问题需交流或业务对接,可与IVDEAR团队取得联络。
IVDEAR可为各大医疗器械企业提供:临床实验研究解决方案、产品国际注册解决方案、自测产品可用性研究解决方案、欧代服务、英代服务、技术文件编写、技术文件咨询及预审核等。
 IVDEAR(艾维迪亚)是国瑞中安集团旗下重点培育品牌-位于深圳光明新区分支机构。依托国瑞中安集团强有力的资源、渠道和专业背景,IVDEAR专注于为国内外各大企业提供全球各国医疗器械合规化咨询全过程、全方位服务,致力于协助和支持中国本土企业迈向全球化、合规化。
IVDEAR(艾维迪亚)是国瑞中安集团旗下重点培育品牌-位于深圳光明新区分支机构。依托国瑞中安集团强有力的资源、渠道和专业背景,IVDEAR专注于为国内外各大企业提供全球各国医疗器械合规化咨询全过程、全方位服务,致力于协助和支持中国本土企业迈向全球化、合规化。
举报/反馈