流式课堂|流式实验该准备多少管样本?如何设置对照?
实验过程中,老师们或许会有疑问:一个完整的流式实验中,到底需要几种对照,需要准备多少管样本来设置对照呢?
下面,我们为大家总结6种常见的流式对照设置,并以CD3-APC、CD4-FITC、CD8-PE三色实验为示例,为大家提供样本管设置参考。
01
空白对照——用于调节仪器电压
空白对照,即不添加任何荧光染料的对照管。设置空白对照,是为了区分细胞本底的自发荧光,及判断药物处理等外界因素是否会额外引入自发荧光。
此外,空白管细胞为可能存在的最负阴性总群体的位置,能辅助电压的调节,避免上机时因电压过低导致的阴性细胞群压线。
02
单阳对照——用于多色补偿调节
单阳对照即单阳管,是只添加一种荧光抗体的样本管。多色流式实验中,由于荧光素的发射波长覆盖范围较广,荧光可能产生重叠,对实验结果的数据分析造成一定的干扰。此种情况下,我们通常会设置单阳管进行补偿调节。同时,单阳管还可以辅助我们调节通道电压,防止信号超出接收范围。
一般来说,实验panel有几种荧光,就需要设置几个单阳管。
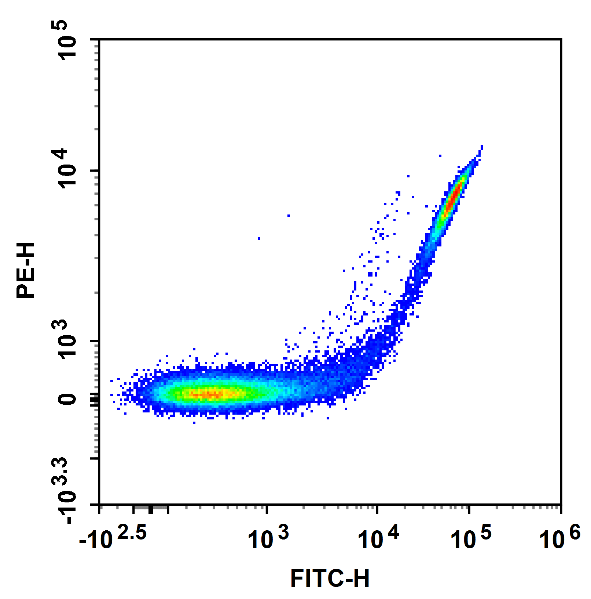 (a)补偿前
(a)补偿前
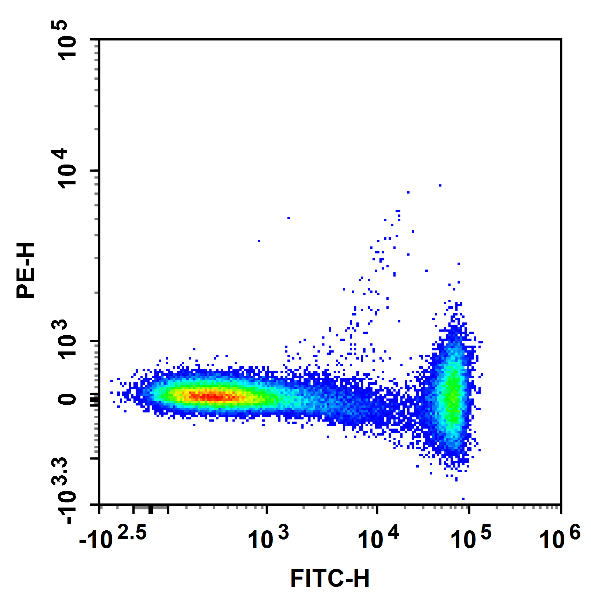 (b)补偿后
(b)补偿后
图1 单阳管校正光谱重叠:CD4-FITC单染的淋巴细胞,在PE通道中检测到荧光(a),但在正确补偿后,FITC荧光溢漏到PE通道的信号被正确扣除(b)。
03
同型对照——用于设门
同型对照(Isotype Control),是指与使用的流式抗体具有相同种属来源、亚型、荧光标记物、使用剂量和浓度,但对目标靶点无特异性结合的抗体。同型对照通常用来消除抗体的非特异性结合造成的背景染色。
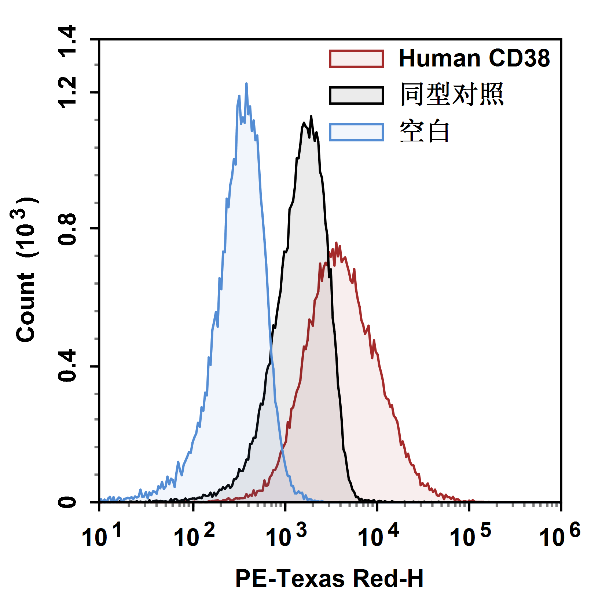 图2 同型对照用于确定门的位置:Human CD38在人外周血淋巴细胞中,是连续性表达指标。用不染任何抗体的空白管(蓝色)划门,和染对应抗体的同型对照(黑色)划门对比。
图2 同型对照用于确定门的位置:Human CD38在人外周血淋巴细胞中,是连续性表达指标。用不染任何抗体的空白管(蓝色)划门,和染对应抗体的同型对照(黑色)划门对比。
04
FMO对照——用于设门
FMO对照是Fluorescence Minus One(荧光扣除一)的缩写。在多色实验中,可能会出现某些通道信号难以区分的情况,主要原因是其他某个荧光对该通道的干扰很大,不能使用未染色的空白对照或全部用同型对照来设门。要记住,每增加一种荧光,整体荧光渗漏等情况都会发生改变,因此需要使用荧光扣除对照(即依次在所有的荧光标记中去掉一个)。
 图3 FMO对照划门更准确:以空白管来确定阴性细胞群(灰色线)和以FMO对照来确定阴性细胞群(红色线)对比。
图3 FMO对照划门更准确:以空白管来确定阴性细胞群(灰色线)和以FMO对照来确定阴性细胞群(红色线)对比。
05
FMO联合同型对照——用于设门
FMO联合同型对照,即FMO与被去掉的抗体对应的同型对照抗体的“组合”对照。FMO对照和同型对照反映的是两种类型的背景荧光,因此,在多色流式实验时,单独使用其中的一种来设门并不可靠。目前,人们试图结合FMO(考虑荧光溢漏)和同型对照(考虑抗体非特异性结合)来设门,该方法也是目前杂志投稿比较容易接受的对照。
06
实验对照——用于解决科研问题
实验对照,也叫生物学对照,不用于设置补偿或设门,而是用于比较样本与特定实验条件下的标本之间的差别。例如,在研究某种药物对某细胞株的影响时,需要设置未经药物处理的相同细胞株作为实验对照。
示例:完整的CD3-APC、CD4-FITC、CD8-PE的3色实验样本管设置

注:“-”表示不加抗体,“*”表示加入对应的同型对照
说明:
1. 一般来说,像CD3、CD4、CD8这种分群明显的指标,不需要设置同型对照;
2. 是否需要设置FMO对照,视荧光的干扰程度而定。本实验中,可以不设置FMO联合同型对照;
3. 对于这种荧光干扰小的Panel(如本实验),首次实验时,建议做单阳对照,后期可以不设置单阳对照。如果是新手老师,建议每次都做单阳管。
举报/反馈