首都医科大学阐述肝再生增强因子蛋白稳定性失衡促进脂肪肝向肝癌发展的机制
近日,首都医科大学基础医学院谢萍教授与安威教授联合在肿瘤学主流杂志《Oncogene》在线发表题为“Imbalance in ALR ubiquitination accelerates the progression of nonalcoholic steatohepatitis to hepatocellular carcinoma”的研究论文。该研究利用临床标本、遗传学小鼠模型、细胞生物学和分子生物学等多种手段,发现肝再生增强因子(ALR)蛋白稳定性失衡与肝癌的发生发展紧密相关,在肝癌进展过程中,泛素连接酶MDM2和去泛素化酶USP36协调调控ALR的蛋白稳定性,从而影响了线粒体的能量代谢,参与了肝癌的发生发展。基础医学院细胞生物学系2019级博士研究生郑铭喆为第一作者,谢萍教授和安威教授为通讯作者。

肝细胞癌(HCC)是常见恶性肿瘤,发病率位居全球第三位。我国是肝癌大国,肝癌发病人数和死亡人数均位居世界首位。除病毒性肝炎感染,近来研究表明非酒精性脂肪肝炎(NASH)是HCC发病的重要诱因,但NASH如何促进HCC尚不完全明确。安威教授团队长期从事肝脏保护与再生方面的研究,尤其是发现了ALR是一个肝脏保护因子,定位于线粒体膜间隙,为一种巯基氧化酶,在酒精性肝损伤、肝移植手术所致的肝脏冷缺血/再灌注损伤等疾病中均起重要保护作用。有文献提示,肝脏ALR敲除小鼠表现为NASH加重,同时伴有HCC的发生发展,但在NASH向HCC进展过程中,ALR表达受何种机制调节、以及其在疾病进程中的作用并不清楚。
本研究中,团队首先明确了NASH和HCC患者组织中ALR蛋白水平显著下调,且与HCC病理评分呈负相关关系;利用肝细胞特异性Alr基因敲除小鼠模型,发现ALR缺失可显著加速高脂饮食诱导的NASH向HCC进展,进而确定了ALR在NASH-HCC进展中的负向调控角色和抑癌功能。已知泛素-蛋白酶体系统对于控制蛋白稳定性起关键性作用,因而团队接下来寻找调控ALR蛋白稳定性的可能泛素-蛋白酶体成员。通过免疫沉淀-质谱分析联合UbiBrowser生信预测,并经免疫共沉淀实验证实,泛素连接酶MDM2可催化ALR泛素化修饰并加速其降解,而去泛素化酶USP36则去除ALR泛素化修饰并增强其蛋白稳定性,明确了二者分别作为E3和DUB来调控ALR蛋白的稳定性。接下来,研究人员检测了NASH-HCC进展过程中小鼠肝组织ALR、MDM2和USP36的蛋白表达水平,发现MDM2在肝癌组织表达上调,而USP36表达下调,导致了ALR与MDM2的相互作用增强,而与USP36的相互作用减弱,因此,ALR的泛素化修饰水平明显升高,使得ALR在肝癌中表达下调。最后,团队利用肝脏转录组学测序发现,敲除肝脏ALR可使脂化肝细胞氧化磷酸化受阻而糖酵解增加,从而促进肝细胞恶性表型转化,导致了HCC的发生。
上述研究不仅揭示了一种全新的肝癌发病机制,而且为肝癌提供了一个新的有潜力的治疗靶点。
该项研究受国家自然科学基金(32071128)资助。
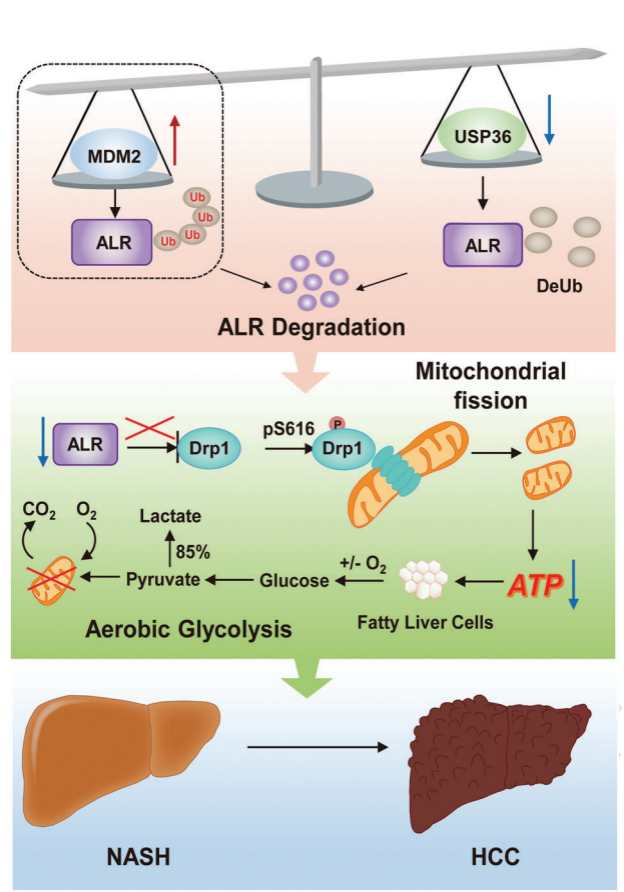
图:在NASH向HCC进展过程中,泛素连接酶MDM2和去泛素化酶USP36稳态失衡促进ALR蛋白降解,导致肝细胞能量代谢异常,加速肝癌发生发展。