母乳中含有益生菌吗?
是否有权威的机构的研究证据表明 ,母乳中含有益生菌呢?新生儿需不需要额外补充益生菌?
(原文链接为www . elsevi er . com/locate/an aero b e,下文为中文翻译。)
M. Gueimonde在厌氧微生物 16 (2010) 307-310曾发表过《母乳和婴儿肠道中乳酸菌和双歧杆菌微生物群的建立和发展》,提出:母乳含有活性乳杆菌和双歧杆菌,通过为婴儿提供这种细菌的持续来源,可能在新生儿微生物群的建立和发展中发挥作用。研究背景:新生儿乳酸菌和双歧杆菌的最初建立,以及母乳作为这些微生物来源的作用尚未完全清楚。方法和结果:本研究评估了 20 名阴道分娩的足月母乳喂养婴儿头 3 个月微生物的建立,及其对应的母乳样本中活性双歧杆菌的存在情况。出生 1 天的新生儿,肠球菌和链球菌的检出率最高,而从 10 天到 3 个月,双歧杆菌则成为主要种类。在母乳中,链球菌检出率最高,乳杆菌和双歧杆菌也有检出。结论: 母乳中存在活性乳杆菌和双歧杆菌,它们可能在新生儿微生物群的最初建立中发挥作用。引言:
新生儿的肠道定殖对肠道黏膜屏障的建立、成熟和维持都很关键[1]。越来越多的证据表明,肠道最初的微生物定殖对健康有着重要影响,该过程中的特定异常可能会使得日后易感于某种疾病[2]。
早期最先定殖的是兼性厌氧菌,如肠杆菌、大肠菌群以及乳杆菌,然后是厌氧菌,如双歧杆菌、拟杆菌和梭菌。接着,喂养方式影响了不同微生物的浓度[1]。
母乳喂养和配方奶喂养婴儿的微生物群最大区别在于双歧杆菌的数量和菌种组成。的确,母乳促进健康的作用被认为与不同的双歧因子有部分关联,最近的研究也将其与母乳中的乳酸菌和双歧杆菌的存在相联系[3-5]。
增加乳酸菌和双歧杆菌的水平是婴儿配方奶的目标,最常用的方法就是添加益生元成分。而另外一种方式则是补充益生菌,主要是乳杆菌和双歧杆菌。应用母乳中分离的菌种可增加配方奶与母乳的相似度。在这种情况下,由于在健康婴儿微生物群中的优势地位,及其积极作用和安全记录,使得双歧杆菌极具吸引力。有多项研究集中于婴儿微生物群。
然而,关于新生儿乳酸菌和双歧杆菌的最初建立,以及母乳作为婴儿肠道定殖细菌的来源的作用方面的信息还很有限。增加我们对乳酸菌和双歧杆菌微生物群的最初建立过程的理解,将有助于促进配方奶喂养的或早产婴儿肠道的定殖过程的战略的发展。
本研究的首要目标是评估阴道分娩的、纯母乳喂养的足月婴儿及其母亲的母乳,在分娩 3 个月内的乳酸菌和双歧杆菌微生物群的建立和发展。第二个目标是评估母乳中活性双岐杆菌的存在情况。
1. 材料和方法
样本
Cabue?es 医院(西班牙,希洪)招募 20 对母婴(足月)。收集其第 1,10,30 和 90 天的母乳和婴儿粪便样本。母乳样本由手工挤压获取,取样前使用在无菌水中浸过的纱布清洁乳头和乳晕,并舍弃前几滴乳汁。所有婴儿(11 名男婴,9 名女婴)均出生于本院新生儿科,妊娠过程无并发症。婴儿经阴道分娩,妊娠期为 39.2 周(95% 置信区间;38.6-39.7),出生体重为 3.403 kg(95% 置信区间;3.238-3.568kg)。所有婴儿和母亲在取样期间均未接受抗生素治疗。有 5 名母亲在产前接受了一个疗程的氨比西林治疗。
本研究通过了阿斯图里亚斯市当地公共卫生服务(SESPA)的伦理委员会的伦理审查,所有参与试验的母亲均签署了书面的知情同意书。
1.2. 微生物平板计数
新鲜的粪便样本立即存放于医院的厌氧罐(Anaerocult A 系统,默克公司,德国达姆施塔特市)中,并于 2 小时内送至实验室。样本接收后,立即存放在 Mac 500 培养室(Don Whitley Scientific公司,英国西约克郡)中,在厌氧环境下(10% 氢气, 10% 二氧化碳 和 80% 氮气)处理。为了分析乳酸菌和双歧杆菌水平,将样本连续稀释于还原培养基中,其中包含 BHI 肉汤(默克),0.5%葡萄糖、0.5%酵母提取物(默克)、 0.25%L-半胱氨酸(Sigma,美国,密苏里州,圣路易斯市)、10μg/L 维生素 K1(默克)和 0.02 g/L 氯化血红素(Sigma)。将上述稀释液添加于混合有 0.25% L-半胱氨酸(Sigma)的 MRS 培养基(Difco, Becton, Dickinson 和公司,法国克莱桥)中,厌氧培养 48 小时。进行菌落计数并分离,以供进一步鉴定。
1.3. 通过 16S rRNA 基因的部分序列分析,对分离菌落进行菌种鉴定
对呈现不同形态的菌落分别计数,并从计数板分离,通过 16S rRNA 基因的部分序列分析,进行菌种鉴定。过程简述如下,将分离的菌落于 37 ℃厌氧箱中的 MRSc 肉汤中培养过夜,然后,离心提取 1mL 细胞,采用 GenElute?细菌基因组 DNA 提取试剂盒(Sigma),按照生产商的说明提取细菌的 DNA。16S RNA 基因的部分扩增和分离菌落鉴定的操作过程如前文所述 [6]。PCR 产物经 GenElute? PCR 纯化试剂盒(Sigma)进行纯化。在 Secugen SL 公司(西班牙马德里)采用 ABI Prism 自动测序仪(Applied Biosystems 公司,美国加州福斯特城)对 PCR 产物进行自动序列分析。
1.4. 双歧杆菌分离菌落的基因分型 将分离的双歧杆菌菌落的 DNA 提取物通过随机扩增多态性DNA(RAPD)分析,进行基因分型。所使用的引物(OPA-2)和反应条件如前文所述 [7].
1.5. 统计学分析
采用 t 检验比较服用与未服用抗生素的母亲的婴儿粪便和母乳样本中细菌水平的差异。统计学分析采用 SPSS 11.0 软件完成(SPSS 公司,美国,伊利诺伊州,芝加哥)。
2. 结果
从第 1 天到第 10 天,婴儿粪便在 MRSc 培养基中的细菌计数由8.7 log CFU/g 增加到 10 log CFU/g,随后保持稳定直到研究结束(图1)。
与此相反,母乳中的细菌水平随着研究的开展逐渐从第 1 天的 5 log CFU/mL 下降到第 90 天的 3.7 log CFU/mL( 图 1) 。
有趣的是,在第 1 个采样时间点,产前服用过抗生素与未服用者的婴儿的粪便细菌水平无统计学显著差异(分别为 8.33 ± 1.49 和 8.92 ± 1.20 log CFU/g)。然而,当比较母乳(细菌)水平时,发现前者的计数更低(服药者、未服药者分别为 4.05 ± 0.30 和 5.46 ± 1.09, p < 0.05)。其他任何时间点的样本均未发现统计学显著差异。
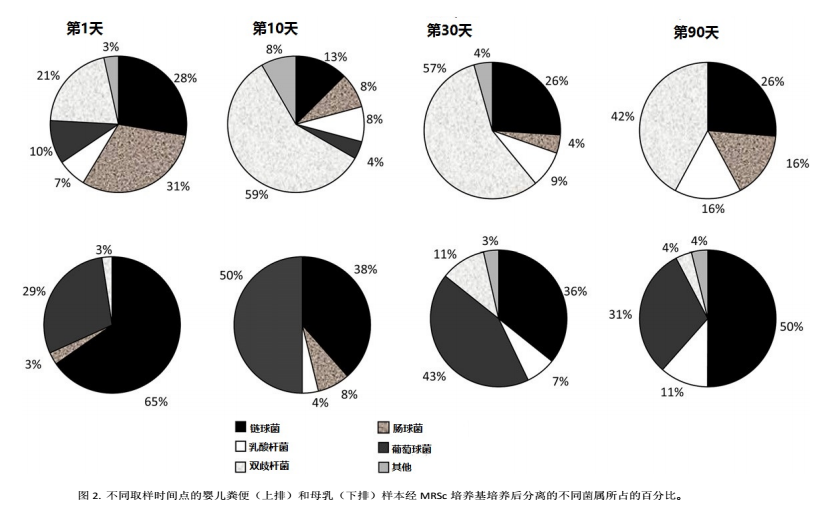
从计数板上提取代表主要微生物群的总共 240 个菌落,分离并鉴定。在第 1 天的新生儿粪便中,肠球菌属和链球菌属(分别占分离菌落的 31%和 28%)分离出的频率最高(图 2 )。其中粪肠球菌和唾液链球菌分别是两个菌属中的主要菌种。在其他 3 个取样时间点(第 10、30、90 天),发现频率最高的微生物属于双歧杆菌属(占分离菌落的 42%到 59%不等,取决于不同的时间点),其次是链球菌,乳杆菌及肠球菌。它们主要包括的分别是长双歧杆菌,其次短双歧杆菌、两歧双歧杆菌、假小链双歧杆菌;以及唾液链球菌,其次前庭链球菌、加氏乳杆菌和粪肠球菌。在大多数样本(20%的出生第 1 天样本和 60%的其他时间点的样本)中,双歧杆菌在MRSc 板出现更多,数量由 7.8 至 10.7 log CFU/g 不等,取决于个体及采样时间。
在母乳中,链球菌(主要是唾液链球菌) 是分离频率更高的乳酸菌。在不同采样时间点,占分离菌落的比例从 36%至 65%不等。培养基里还发现葡萄球菌属(不属于乳酸菌属),在母乳分离的菌落中占 29%到 50%。其中,表皮葡萄球菌发现频率最高。母乳分离的菌落中,5%属于乳杆菌,另有 5%是双歧杆菌或其近亲菌属等不经常从母乳中分离出的厌氧微生物。
在乳杆菌中,最常发现的是加氏乳杆菌。从母乳样本中分离的双歧杆菌包括长双歧杆菌(3 个分离菌落),短双歧杆菌(3 个分离菌落)以及类似双歧杆菌的微生物——栖牙双歧杆菌(1 个分离菌落)。它们的水平在 2.5 至 4.8 logCFU/mL 之间。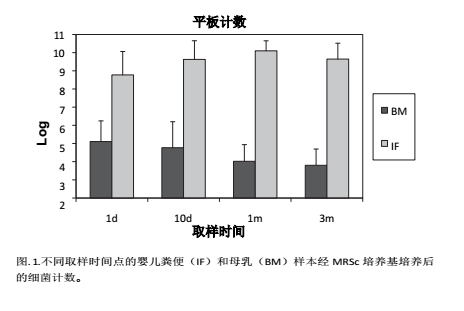


呈现相同 RAPD 图谱的双歧杆菌在母乳和相应的婴儿粪便中,以及同一个婴儿的其他取样时间点的样本中发现(数据未显示)。不同母乳-婴儿对的分离菌落,呈现出不同的 RAPD 图谱。
3. 讨论
已有报道称:母乳喂养婴儿比配方奶喂养婴儿更少地患过敏疾病和胃肠道感染 [2]。因此,母乳喂养婴儿的微生物群可被认为是健康肠道菌群的标准,需要进行定性和定量分析。乳酸菌和双歧杆菌经常被认为是健康微生物群的成员。在母乳喂养婴儿的肠道微生物群中,乳酸菌占有不到1%的比例 [8],而双歧杆菌则可能占主要地位。双歧杆菌的这种优势地位似乎是健康的母乳喂养婴儿的肠道菌群的特征,因此,可能对日后的健康发挥关键作用。
本研究结果展示了母乳喂养婴儿肠道中乳酸菌和双歧杆菌菌群的最初建立和发展,以及这些微生物在母乳中的存在和演变情况。总体上,粪便中发现的乳酸菌和双歧杆菌水平处于之前报道的该人群的水平范围之中 [9,10]。
母乳不易取样,且微生物污染不可避免。唾液链球菌和表皮葡萄球菌(非乳酸菌属)是最常分离出的微生物,它们也被报道为母乳喂养婴儿的特征菌群[11]。Martin 和同事 [3]从母乳中分离出乳酸菌,并在对应的婴儿粪便中发现与母乳中相同的乳酸菌。过往的一项研究报道了母乳中双歧杆菌 DNA 的存在 [4]。那时候,对于母乳中是否存在活性双歧杆菌这一问题仍未有答案。
最近,一项研究的发现与本研究的发现相似,研究中,Martin 等人 [5]报道了在分娩 4 到 7 天的母乳样本中分离出双歧杆菌,表明人乳中存在活性双歧杆菌。这些作者鉴定出短双歧杆菌是分离频率最高的菌种,而在本研究中,长双歧杆菌与之频率相同。
我们发现:呈现相同基因图谱(RAPD 分析)的双歧杆菌在母乳和不同取样时间点的相应的婴儿粪便中发现,表明菌群通过母乳垂直传播至婴儿。同样的图谱在不同婴儿的分离菌落中则未发现,表明出生第 1 个月期间,优势双歧杆菌群在数量上有个体特异性。
本实验所分离的微生物群可能组成极有前途的菌群组合,用于婴儿配方奶粉中。
4. 结论
本研究结果表明,母乳含有活性乳杆菌和双歧杆菌。通过为婴儿提供这种细菌的持续来源,可能在新生儿微生物群的建立和发展中发挥作用。
声明
本研究由西班牙科学和教育部的 RM2007-00003-00-00(INIA)项目提供经费支持。
新生儿需不需要补充益生菌,请参考我的回答:
新生儿需要吃益生菌吗? - 幼儿
参考文献
[1]Penders J, Thijs C, Vink C, Stelma FF, Snijders B, Kummeling I, et al. Factors influencing the composition of the intestinal microbiota in early infancy. Pediatrics 2006;118:511e21.
[2]Kalliomaki M, Kirjavainen P, Eerola E, Kero P, Salminen S, Isolauri E. Distinct patterns of neonatal gut microflora in infants in whom atopy was and wasnot developing. J Allergy Clin Immunol 2001;107:129e34.310 G. Solís 等人 / 厌氧微生物 16 (2010) 307e310
[3] Martín R, Langa S, Reviriego C, Jimenez E, Marin ML, Xaus J, et al. Human milk is a source of lactic acid bacteria for the infant gut. J Pediatr 2003; 143:754e8.
[4]Gueimonde M, Laitinen K, Salminen S, Isolauri E. Breast milk: a source of bifido-bacteria for infant gut development and maturation? Neonatology 2007;92:64e6.
[5]Martín R, Jiménez E, Heilig H, Fernandez L, Marin ML, Zoetendal EG, et al.Isolation of bifidobacteria from breast milk and assessment of the bifido- bacterial population by PCR-DGGE and qRTi-PCR. Appl Environ Microbiol 2009;75:965e9.
[6]Gueimonde M, Delgado S, Mayo B, Ruas-Madiedo P, Margolles A, de los Reyes-Gavilan CG. Viability and diversity of probiotic Lactobacillus and Bifidobacte-rium populations included in commercial fermented milks. Food Res Int 2004;37:839e50.
[7]Matto J, Malinen E, Suihko M-L, Alander M, Palva A, Saarela M. Genetic heterogeneity and functional properties of intestinal bifidobacteria. J Appl Microbiol 2004;97:459e70.
[8]Favier CF, Vaughan EE, De Vos WM, Akkermans ADL. Molecular monitoring of succession of bacterial communities in human neonates. Appl Environ Microbiol 2002;68:219e26.
[9]Fanaro S, Chierici R, Guerrini P, Vigi V. Intestinal microflora in early infancy: composition and development. Acta Paediatr 2003;(Suppl. 441):48e55.
[10]Mitsou EK, Kirtzalidou E, Oikonomou I, Liosis G, Kyriacou A. Fecal microflora of greek healthy neonates. 厌氧微生物 2008;14:94-101.
[11]Jimenez E, Delgado S, Maldonado A, Arroyo R, Albujar M, Garcia N, et al. Staphylococcus epidermidis: a differential trait of the fecal microbiota of breast- fed infants. BMC Microbiol 2008;8:143.
未经授权,严禁转载 !
未经授权,严禁转载 !
未经授权,严禁转载 !