科普|从抗体药物偶联物(ADC)的作用机制,走进Polatuzumab的研发故事
1913年,德国科学家Paul Ehrlich提出了“Magic bullets“(神奇的子弹)设想,该设想的核心理念就是“能否找到一种分子可以特异性的针对致病细胞或机体”。这一理念在当时远远超前于技术,直到1975年,分子生物学家Georges J.F. K?hler和César Milstein在自然杂交技术的基础上,创建杂交瘤技术,并首次制备出单克隆抗体,才将上述设想往前推进了一大步。
自此,单克隆抗体药物蓬勃发展,期间诞生了诸如利妥昔单抗、曲妥珠单抗等重磅炸弹级药物,并在临床得到广泛的应用。
但是很多裸抗药物的临床疗效仍有一定的局限性。因此从药物设计的角度出发,另一拨以西雅图遗传学公司为代表的研发人员尝试将小分子细胞毒药物与抗体药物结合,形成抗体药物偶联物(antibody drug conjugates, ADC),既能保证靶向性,也能改善细胞毒药物的治疗窗。至此,这种新型抗癌药物开始进入人们的视野并逐渐成为发展热点。
ADC药物,不仅是简单的偶联
ADC药物看起来很简单,单克隆抗体与强细胞毒性的化疗药物通过连接子结合而成。理想状态下,ADC药物进入体内后,抗体部分与表达肿瘤抗原的靶细胞特异性结合,ADC药物被肿瘤细胞内吞后,进入溶酶体进行降解,小分子细胞毒药物在胞内以高效活性形式被足量释放,从而完成对肿瘤细胞的杀伤。理想是丰满的,但现实却是骨感的。一个成功的ADC药物需要完成诸多步骤的筛选。
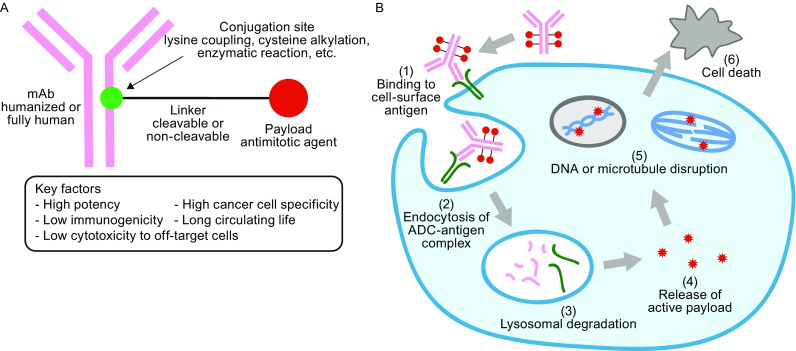
图2:ADC药物的结构和作用机制示意图
图片来源:Protein Cell. 2018 Jan;9(1):33-46
1、靶点/抗原的选择和抗体的选择
靶点的选择是设计ADC药物的起点,确定了ADC药物将针对哪些肿瘤适应证,同时潜在影响所偶联的细胞毒药物的选择。靶点选择的基本依据是在肿瘤细胞中高表达而在正常细胞中低表达或不表达,这一条标准足够严格,以致于根据此标准根本找不到什么好的靶点。因此,在选择靶点时,还需要综合其他因素,包括表达该抗原的细胞类型、细胞所处的周期状态(如分裂期或静止期)、靶标的表达水平、以及靶点可及性等。
关于靶点的可及性,实体瘤相对于血液肿瘤而言,具有更高的阻碍性。实体瘤的微环境等因素导致药物难以渗透,就这一层面而言,血液肿瘤的可及性更好,这也是为什么ADC药物会先在血液肿瘤领域取得突破的关键因素所在[美国食品药品监督管理局(FDA)在2011年批准Brentuximab Vedotin(商品名:Adcetris)治疗霍奇金淋巴瘤和间变性大细胞淋巴瘤]。
受益于过去几十年间的抗体改造技术,人源化和全人源抗体已成为抗体药物的主流,有效降低了免疫原性。在ADC药物的设计中,抗体的筛选需要考虑以下几个因素:特异性的结合、抗原抗体复合物介导ADC药物的内吞效率以及内吞后细胞内的准确定位(如溶酶体)等。此外,对于抗体的修饰,如对于抗体恒定区的糖基化修饰或者对于连接位点的修饰均有助于改善药物的特质和疗效。
2、细胞毒药物的选择
目前仅有少数几种细胞毒药物及其衍生物用于ADC药物的设计中,主要分为以下两类:微管抑制剂/稳定性破坏剂,如奥瑞他汀衍生物(monomethyl auristatin, MMAE/MMAF)、美登素类衍生物(DM1/DM4),以及作用于DNA凹槽/破坏双螺旋结构的卡齐霉素及其衍生物。
这几类细胞毒性小分子药物对于增殖的肿瘤细胞具有高效的杀伤作用。MMAE/MMAF对于肿瘤细胞的IC50约为10-7-10-10mol/L;DM1/DM4的IC50约为10-10-10-12mol/L;卡齐霉素的IC50约为10-10mol/L。
3、连接子的选择
连接子在ADC药物未达到肿瘤细胞之前需足够稳定,否则会产生非预期的毒性。目前在临床应用中的ADC药物所含的连接子主要分为两大类:可裂解的和不可裂解的。
可裂解的连接子主要包括化学不稳定连接子,如酸不稳定性连接子(腙类,可在溶酶体等酸性环境有效裂解)和二硫化物的连接子(可在还原性的胞内环境被谷胱甘肽选择性裂解),以及酶催化裂解连接子(肽类连接子,可被蛋白酶裂解)。不可裂解的连接子主要为硫醚连接子(R-S-R)。
可裂解的连接子在ADC药物被裂解后释放出来的细胞毒药物可以穿透细胞膜并杀死周围的肿瘤细胞,被称为旁观者效应(bystander effect);与此相反,对于不可降解的连接子,抗体部分即使被蛋白酶降解,仍有氨基酸残基与连接子和细胞毒药物相连,这种带电荷的代谢产物无法有效的穿过细胞膜,因此通常不具备旁观者效应。
一个重要的概念:药物抗体比
每个抗体上连接的细胞毒药物的个数即为药物抗体比(DAR,drug-to-antibody ratio)。从下图中可以看出,当DAR越大时,ADC药物的药物代谢速率增加,半衰期降低,全身毒性也会随之增加。理想状态下,DAR为4时,药物的疗效最高。因此在实际生产中,通过质量控制、纯化工艺将DAR小于2或DAR大于4的药物去除,以保证药物的均一性。如Thiomab技术,最早由Genentech公司报道,在特定位点插入半胱氨酸残基,随后与细胞毒药物进行位点专一的偶联,最终成品较为均一,DAR介于2-4的ADC药物占比较高。
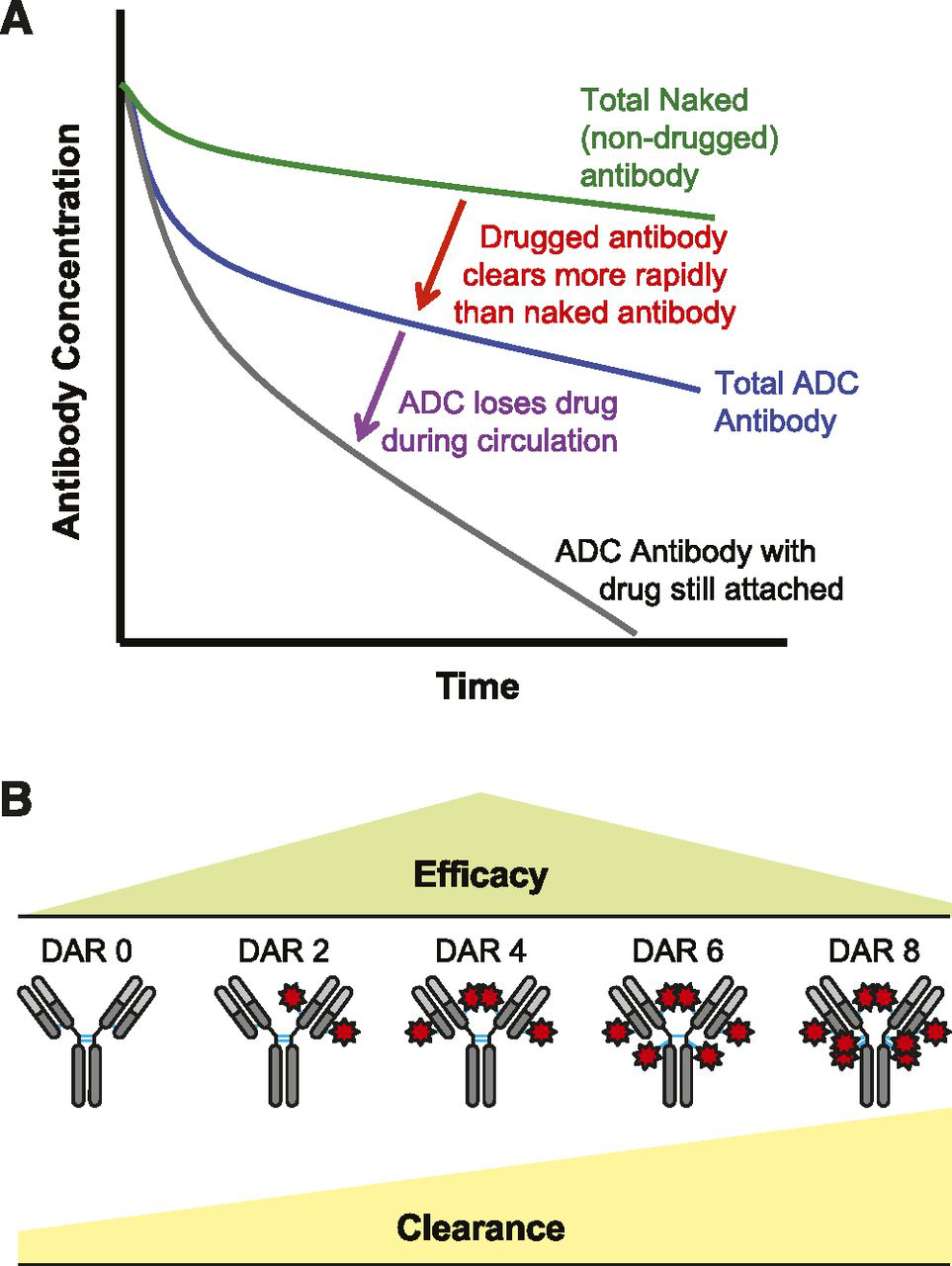
图3:ADC药物受DAR影响药代动力学示意图
图片来源:Pharmaceuticals (Basel). 2018 Apr 9;11(2)

图4:不同药物偶联方式导致ADC药物成品均一性存在差异
图片来源:Process Development and Manufacturing of Antibody-Drug Conjugates (chapter 40)
实例:ADC药物
Polivy(polatuzumab vedotin)的诞生
2002年4月,两个生物技术领域的业界翘楚西雅图遗传学公司(Seattle Genetics)和基因泰克就ADC药物的研发达成了一项多年的合作协议。在这份协议中,西雅图遗传学公司提供技术,而基因泰克负责研发、生产和商业化,同时基于任何产出成果的净收入支付授权费。在之后几年,两家公司先后几次扩大了合作协议,基因泰克通过支付技术访问费、购买后者的普通股票等方式获得特定靶点独家许可以及其他靶点的ADC技术使用权限。
对于血液肿瘤而言,利妥昔单抗的成功为淋巴瘤患者的治疗带来了质的飞跃,同时提示靶向B细胞表面抗原是非常有效的治疗策略。后利妥昔单抗时代,是否还能开发出更有效的药物来治疗复发/难治(R/R)的淋巴瘤患者?研究人员再次将目光聚焦到B细胞表面的靶点,包括CD19、CD22、CD79、CD180等。
早期的体外研究结果显示,对于制备ADC药物而言,靶向CD22和CD79表现出了更优的潜力。CD79是B细胞受体(BCR)的组成部分,在信号转导过程中起着非常关键的作用;而CD22作为BCR的共受体,可以与BCR交联,抑制信号传导。与其他B细胞表面抗原不同,CD22和CD79在与抗体结合后,可以迅速内吞;此外与CD20一样,CD22和CD79均主要在成熟B细胞中表达,这就意味着即使正常B细胞被耗竭掉,也能够通过造血干细胞和前体B细胞补充获得。通过数年的潜心研究,靶向CD22的pinatuzumab vedotin和靶向CD79b的polatuzumab vedotin应运而生。
早期开展的ROMULUS研究在6个国家的39个研究中心进行,这项II期临床研究比较了R-pina和R-pola治疗R/R弥漫性大B细胞淋巴瘤(DLBCL)/滤泡性淋巴瘤(FL)的疗效。研究结果显示,R-pola(利妥昔单抗+polatuzumab vedotin)和R-pina(利妥昔单抗+pinatuzumab vedotin)均表现出了较好的疗效和安全性,但R-pola组的缓解持续时间(DoR)要长于R-pina组,前者的总体获益风险更好,这可能也是polatuzumab vedotin被选择进入后续开发的部分原因所在。
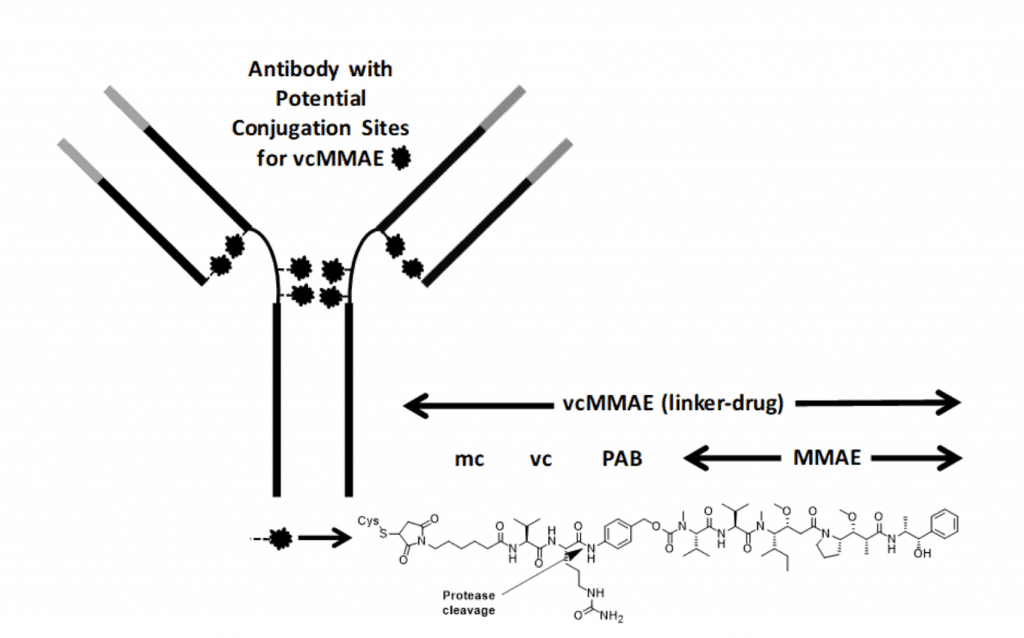
图5:polatuzumab结构示意图
图片来源https://www.adcreview.com/polatuzumab-vedotin-drug-description/
Polatuzumab vedotin的抗体部分通过mc-vc-PAB(马来酰亚胺基己酰基-缬氨酸-瓜氨酸-对氨基苯甲酰氧基羧基)连接子与MMAE相连(vcMMAE),可以特异性的结合B细胞表面的CD79b抗原,通过内化和酶切(上图箭头处为酶切位点)释放MMAE,后者通过结合微管蛋白tubulin,抑制其聚合,导致细胞周期G2/M期停滞和肿瘤细胞的凋亡。
Polatuzumab的分子量大小在150KDa,平均药物抗体比(drug-to-antibody ration)达到较为理想的3.5,为其良好的疗效奠定了理论基础。
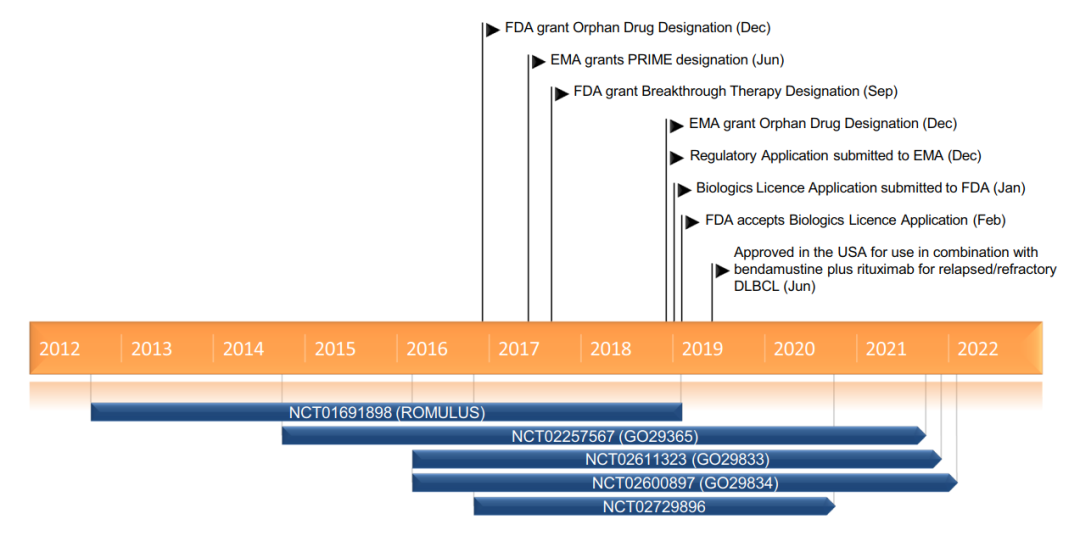
图6:polatuzumab研发进程中的主要里程碑事件
图片来源:Drugs. 2019 Sep;79(13):1467-1475.
2019年polatuzumab先后获得FDA和EMA的批准
2019年6月,FDA批准Polatuzumab联合苯达莫司汀和利妥昔单抗(Pola-BR)治疗既往已接受过至少两种方案的R/R DLBCL成人患者。该获批基于一项1b/2期临床试验数据(GO29365),该研究结果显示Pola-BR组完全缓解率可达BR组的2倍以上 (40% vs.18%,p=0.026),Pola-BR方案显著延长DoR (10.3 m vs. 4.1 m,HR=0.44)、无进展生存(PFS)(7.6 m vs. 2.0 m,HR=0.34)和总生存(OS) (中位OS:12.4 m vs. 4.7 m,HR=0.42)。
2019年11月,欧洲药品管理局(EMA)人用医药产品委员会发布积极审查意见,批准Polatuzumab联合BR方案用于不适合造血干细胞移植的R/R DLBCL患者的治疗。
在过去十年的时间里,多个ADC药物相继获批,在血液肿瘤领域和乳腺癌领域(Kadcyla,T-DM1)均表现出较好的疗效和安全性,但仍面临着许多挑战和未知,如潜在靶点的选择、改善脱靶效应所带来的潜在毒性、更好的控制DAR以降低ADC药物的异质性、开发其他作用机制的细胞毒药物等。科学家一直在研发的路上,承袭Paul Ehrlich的设想,希望在与癌症抗争的过程中,能够发现更多的“神奇的子弹”。
参考文献
[1]Lambert JM. Antibody-Drug Conjugates (ADCs): Magic Bullets at Last!. Mol Pharm. 2015;12(6):1701–1702. doi:10.1021/acs.molpharmaceut.5b00302
[2]Tsuchikama K, An Z. Antibody-drug conjugates: recent advances in conjugation and linker chemistries. Protein Cell. 2018;9(1):33–46. doi:10.1007/s13238-016-0323-0
[3]Thomas A, Teicher BA, Hassan R. Antibody-drug conjugates for cancer therapy. Lancet Oncol. 2016;17(6):e254–e262. doi:10.1016/S1470-2045(16)30030-4
[4]Ramírez J, Gilardoni G, Ramón E, et al. Phytochemical Study of the Ecuadorian Species Lepechinia mutica (Benth.) Epling and High Antifungal Activity of Carnosol against Pyricularia oryzae. Pharmaceuticals (Basel). 2018;11(2):33. Published 2018 Apr 19. doi:10.3390/ph11020033
[5]Deeks ED. Polatuzumab Vedotin: First Global Approval [published correction appears in Drugs. 2019 Nov;79(16):1829]. Drugs. 2019;79(13):1467–1475. doi:10.1007/s40265-019-01175-0
[6]Morschhauser F, Flinn IW, Advani R, et al. Polatuzumab vedotin or pinatuzumab vedotin plus rituximab in patients with relapsed or refractory non-Hodgkin lymphoma: final results from a phase 2 randomised study (ROMULUS). Lancet Haematol. 2019;6(5):e254–e265. doi:10.1016/S2352-3026(19)30026-2
[7]Sehn LH, Herrera AF, Flowers CR, et al. Polatuzumab Vedotin in Relapsed or Refractory Diffuse Large B-Cell Lymphoma. J Clin Oncol. 2020;38(2):155–165. doi:10.1200/JCO.19.00172
[8]Shingleton JR, Dave SS. Polatuzumab Vedotin: Honing in on Relapsed or Refractory Diffuse Large B-Cell Lymphoma. J Clin Oncol. 2020;38(2):166–168. doi:10.1200/JCO.19.02587