更“快”的肿瘤新抗原质谱鉴定技术, 加快双特异性抗体的研发
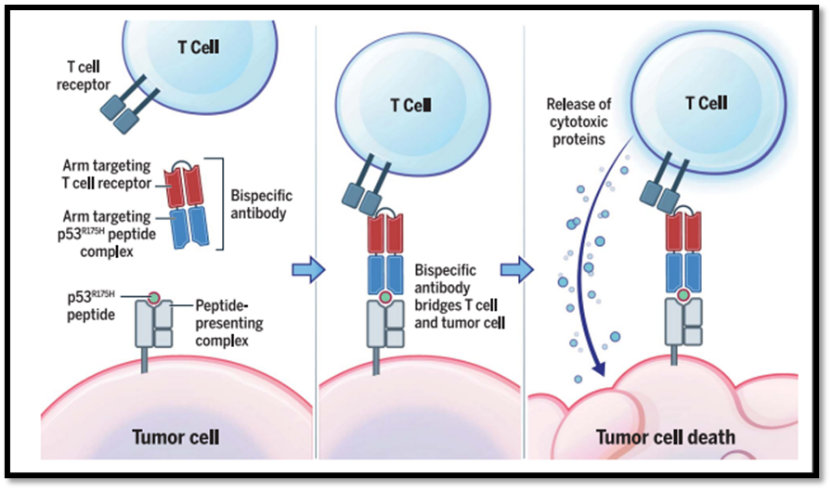
Tumor protein P53 (TP53),也叫p53,是一个抑癌基因。超过50%的癌症病人的TP53基因都有突变。但是以这个基因为靶点的抗肿瘤药物目前为止还不存在。今天介绍的文章提供了一种全新的思路,以TP53突变产生的新抗原为靶点,研发了一种双特异性抗体,该抗体可以提高肿瘤细胞与T细胞的结合效率,进而达到杀死肿瘤细胞的效果。
1. 摘要
本文中,研究人员通过质谱实验验证了一个带有TP53-R175H突变的新抗原肽段确实能够被递呈到细胞膜上。TP53-R175H(第175位的R突变为H)是癌症中最常见的突变,含有这个突变的肽段HMTEVVRHC(突变的H用下划线标记)能够结合HLA-A*02:01。而HLA-A*02:01是美国白人中最常见的HLA I亚型。因此HMTEVVRHC与HLA-A*02:01结合的复合物被认为是极具吸引力的靶点。研究人员通过噬菌体展示技术得到了一种能够特异识别该新抗原与HLA-A*02:01二元复合物的单链抗体。之后通过改造将该抗体与另一个识别CD3ε的单链抗体相连,最终得到一个双特异性抗体。研究人员通过实验证明了肿瘤细胞能够通过该抗体高效地激活T细胞。研究人员进而解析了抗体,新抗原,HLA-A*02:01三元复合物的蛋白质结构。与基于T细胞的免疫疗法相比,该双特异性抗体具有良好的成药性,和很高的潜力可以用来治疗癌症。
2. 实验流程与结果
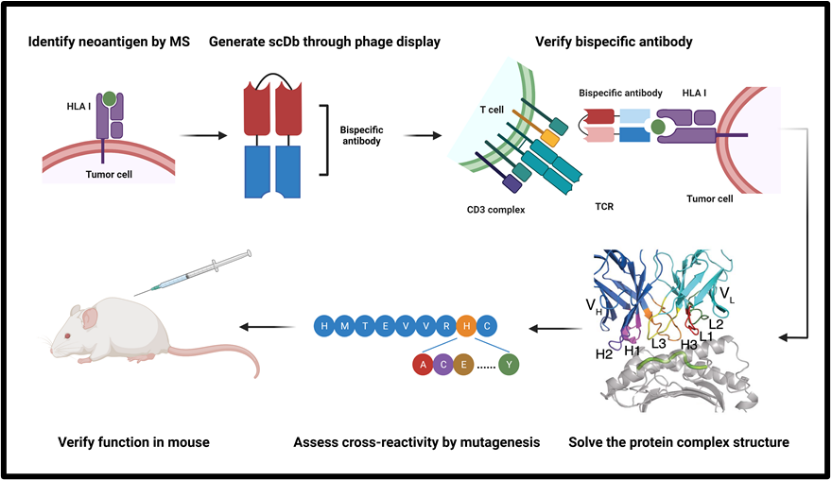
1. 质谱鉴定
研究人员通过质谱实验确定了肽段HMTEVVRHC能够被递呈到细胞膜表面,进而通过定量质谱实验,探明了这个肽段在细胞膜表面的表达量很低,每个细胞只有1-2个拷贝。
2. 利用噬菌体展示技术获得抗体
研究人员采用了一个含有大量scFv的噬菌体库来寻找能够识别HMTEVVRHC与HLA-A*02:01复合物的单链抗体,并成功分离了23种不同的scFv。
3. 构建双特异性抗体
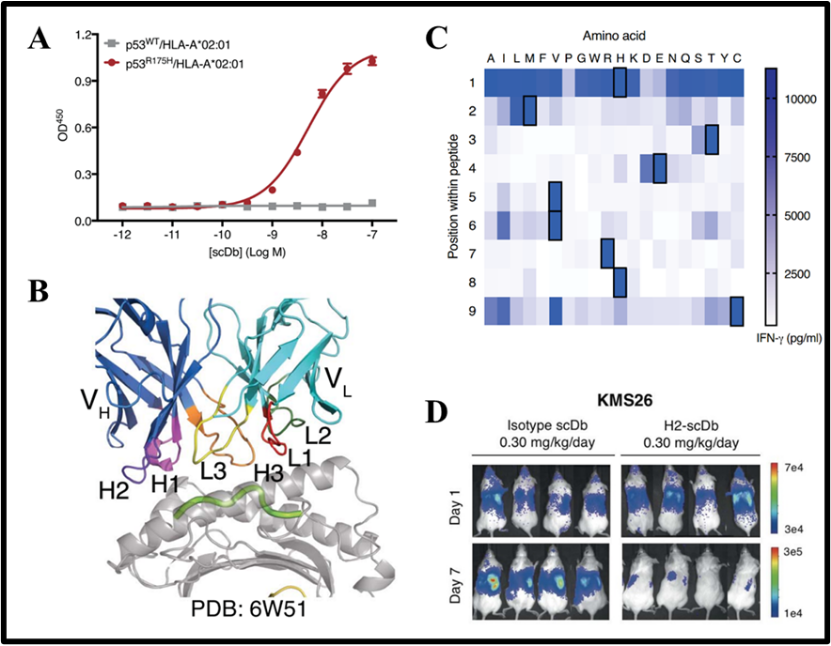
这23种scFv与另外一种能够识别CD3ε的scFv相连被构建成双链抗体。经细胞实验验证,只有H2号双链抗体能够高效地识别HMTEVVRHC与HLA-A*02:01的复合物。见下图A。
4. 解析蛋白质结构
研究人员将H2号抗体, HMTEVVRHC和HLA-A*02:01的三元蛋白质复合物的结构解析出来,其分辨率高达3.5 Å。该蛋白质结构证实,H2识别并结合含有HMTEVVRHC的HLA-A*02:01。见下图B。
5. 验证H2号抗体的特异性
研究人员将肽段HMTEVVRHC中的每一个氨基酸都突变成剩余的19种氨基酸,从而得到171个虚构的肽段。经实验验证其中只有一小部分肽段能够在体外通过H2号抗体激活T细胞。按照这些肽段的序列特征,在人类蛋白质数据库中只找到3个真实存在的肽段。进一步实验证明,这3个肽段都无法被H2号抗体识别,所以H2号抗体具有良好的特异性。见下图C。
6. 在老鼠体内验证H2号抗体的效果
老鼠被接种多发性骨髓瘤细胞,而后注射H2号抗体对其进行治疗。经实验验证,治疗效果显著。见下图D。
3. 更“快”的肿瘤新抗原质谱鉴定技术, 加快双特异性抗体的研发
这篇文章有几个细节值得我们关注:
1. NetMHCpan的预测结果并不准确
经NetMHCpan 4.0预测,HMTEVVRHC与HLA-A*02:01结合的可能性很低(binding affinity: 5177.6nM, rank: 9.7%)。但是本文通过质谱实验成功鉴定到了肽段HMTEVVRHC,再结合文中的其他数据可以断定HMTEVVRHC确实能够与HLA-A*02:01结合,这明显与NetMHCpan 4.0的预测结果不一致。因此,仅靠NetMHCpan 4.0等软件并不能准确地预测出所有的新抗原,最终还是要依赖于质谱实验的结果来进行综合判定。
2. 新抗原在细胞表面呈递量较低
经质谱实验测定,新抗原HMTEVVRHC在KMS26, KLE和TYK-nu细胞表面的呈递量非常低,仅为1-2个拷贝。想要鉴定这类低丰度的新抗原,就必须采用高精度,高灵敏度的质谱仪;同时整个实验流程也要经过精心优化才能避免真正的新抗原在操作过程中被丢掉。
3. 质谱鉴定的新抗原提供了更多的靶点
TP53是一个转录因子,定位于细胞核中。在不裂解细胞的情况下,无论抗体还是CAR-T对这个蛋白都鞭长莫及。但蛋白质总要经过蛋白酶体降解,而降解之后的肽段会由HLA I呈递到细胞膜表面。因此,通过质谱对细胞膜表面HLA I呈递的肽段进行鉴定就能够将那些原先无法企及的蛋白转换成免疫疗法可以攻击的潜在靶点,为癌症的免疫治疗提供更多的可能性。
4. 噬菌体展示技术并非最优的选择
文中通过噬菌体展示技术来筛选单链抗体,成功分离得到H2号抗体。但噬菌体展示文库的容量毕竟是有限的,因此所能得到的抗体的多样性也大打折扣。所以如果能够通过传统的免疫动物的方法来制作抗体将会给研究者提供更多,更优质的候选抗体。但这种方式需要对抗体进行测序之后才能将其改造成双特异性抗体。
上海快序生物科技有限公司目前推出了一套更“快”的肿瘤新抗原质谱鉴定技术服务。这项服务采用质谱仪对新抗原进行鉴定,并不依赖于NetMHCpan 4.0的预测结果。同时采用高精度,高灵敏度的质谱仪对样品进行分析,并对实验流程中的细节进行了深度优化,以减少样品的损失。这项服务能够帮助客户更“快”地鉴定肿瘤新抗原,将那些只表达在细胞内部的蛋白转化为免疫疗法的靶点,同时还能加快双特异性抗体的研发进程。
这项鉴定服务的技术流程如下图所示:
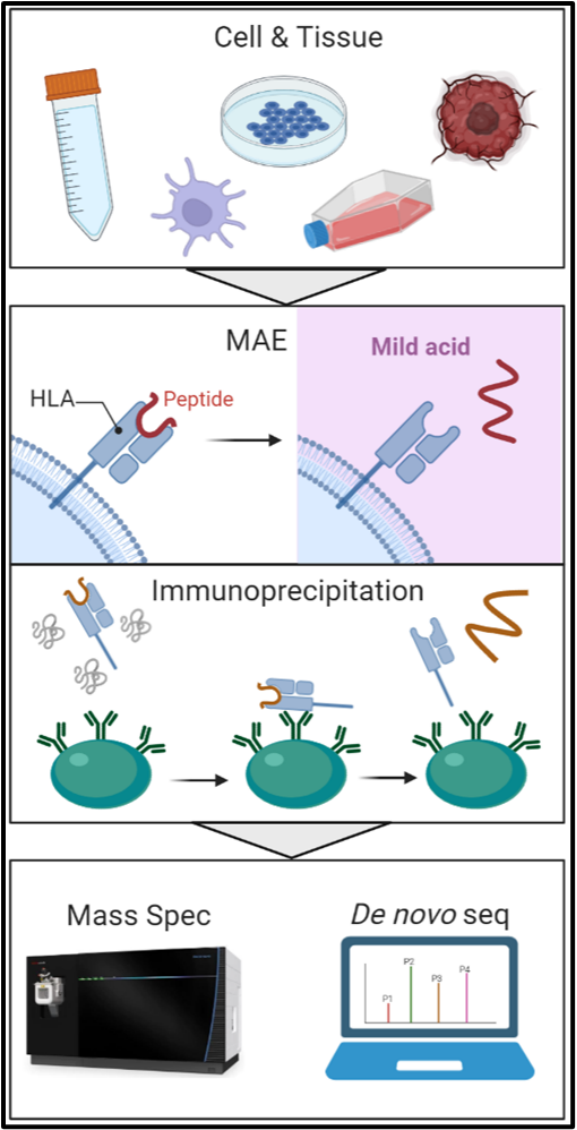
这项鉴定服务的优势如下:
1)更直接,不依赖于基因组测序结果,而是利用质谱鉴定技术对肽段进行测序;
2)更真实,不依赖于NetMHC等预测软件,而是直接从细胞中提取与MHC I结合的肽段,这样测得的数据更接近于细胞中真实的生理状态;
3)更多样,独有的肽段从头测序技术能够鉴定到多种不同来源的突变肽段;
4)更灵活,提供弱酸洗脱(MAE)和免疫沉淀(IP)两种肽段提取方案供客户选择。客户可以根据样品类型选择最优的肽段提取方式,以提高样品的利用率。
同时,快序生物还提供抗体发现服务。该服务可直接从血液或多克隆抗体中对抗体蛋白进行测序,获得单克隆抗体的氨基酸序列,直接高效地发现在免疫系统发挥作用且具高亲和力的天然抗体,便于生产重组抗体,为抗体研发提供全新途径。
参考文献:Hsiue H C , Wright K M , Douglass J , et al. Targeting a neoantigen derived from a common TP53 mutation[J]. Science (New York, N.Y.), 371(6533):eabc8697.
文章链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8208645/