纳米抗体在ADC中的应用
? 前 言
ADC 的概念最初是由 Paul Ehrlich 在 1900 年代初期描述的,他将其描述为"魔法?弹"。抗体偶联药物(ADC)是由靶向特异性抗原的单克隆抗体与小分子细胞毒性药物通过接头连接而成,兼具传统小分子化疗的强大杀伤效应及抗体药物的肿瘤靶向性(见图1)。目前,ADC在血液瘤和实体瘤方面均有多个药物上市,但在实体瘤方面的发展越来越局限,主要问题还是目前的ADC药物分子量太大(IgG骨架约150 kDa),对于实体瘤的组织穿透效果较差。
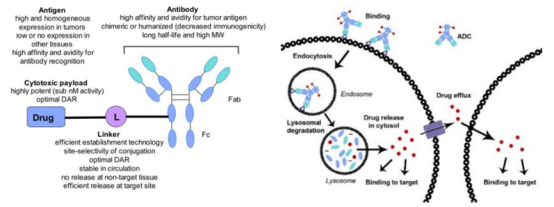
图1. ADC的结构和作用机制
在羊驼外周血液中存在一种天然缺失轻链的抗体,该抗体只包含一个重链可变区(VHH)和两个常规的CH2与CH3区,但却不像人工改造的单链抗体片段 (scFv) 那样容易相互沾粘,甚至聚集成块。更重要的是单独克隆并表达出来的VHH结构具有与原重链抗体相当的结构稳定性以及与抗原的结合活性,是已知的可结合目标抗原的最小单位。VHH晶体为2.5nm,长4nm,分子量只有15KDa,也被称作纳米抗体(Nanobody, Nb)。由于纳米抗体的尺?更?,肿瘤组织穿透能力更强,因此,目前研究人员正在将其应用于ADC药物实体瘤治疗中,以期能改善目前ADC药物中存在的实体瘤组织穿透效果较差的问题,本期小编就将纳米抗体在ADC药物中的应用研究进行介绍。
纳米抗体ADC的优劣势分析
纳米抗体在ADC成药方面优势主要表现在,首先,纳米抗体是由4个FR区和3个CDR区组成,而且纳米抗体的CDR3含有16~18个氨基酸残基,比人和鼠的更长,所以抗原亲和力更高,而且纳米抗体的体积很小,更容易结合到一些比较难结合的表位(见图2);第二,纳米抗体的分子量小,只有15kDa,是普通抗体的十分之一,因此它具有很强的组织穿透力,如果用纳米抗体做ADC,能很好的解决实体瘤组织穿透力差的问题;第三,纳米抗体天然缺失FC,而且本身VH的基因序列跟人的高度同源,所以纳米抗体在人体内的免疫原性很低;第四,纳米抗体的FR区亲水残基的比例比普通的IgG要高,导致他的水溶性更好,这也很好的避免了抗体药在运输过程中的聚集和黏连。
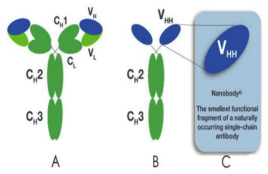
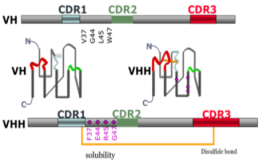
图2. 纳米抗体的结构以及与传统IgG序列上的差异
纳米抗体在ADC成药方面劣势主要表现在,第一个缺点就是半衰期短,导致如果直接用纳米抗体去做ADC,虽然它的组织穿透性很好,但也快会被清除代谢掉,所以,目前开发了几种策略来延长纳米抗体的半衰期,包括聚乙二醇法、多纳米抗体串联、融合白蛋白和融合Fc结构域等等,以弥补它半衰期的短板。连接子和偶联方式的选择问题,这个其实既可以作为一个缺点,因为组装方式太多样化了,可能不知道怎么选,或者说需要做很多预实验或者验证实验,但也可以看做是一个优点,因为它也表明纳米抗体容易改造,也有很多的可能性。
纳米抗体ADC研究进展
目前还没有纳米抗体ADC上市药物,但是已经有了一些文献报道和实验数据表明纳米抗体ADC的一些优势。其中,2022年4月份复旦大学基础医学院的应天雷、吴艳玲团队和复旦大学生命科学学院丁澦团队合作,开发了一种稳定性高、分布快、肿瘤穿透性强的全人源纳米抗体偶联药物(Fully human single-domain antibody-drug conjugate,UdADC)。在本研究中,开发了一株针对癌胚抗原5T4的高亲和力全人源纳米抗体n501。研究发现与传统的驼源纳米抗体相比,全人源纳米抗体n501具有更优异的稳定性,在高温等严苛的储存条件下仍能保持抗原结合活性。利用结构生物学的方法解析了n501和5T4复合物的高分辨率三维结构,显示全人源纳米抗体与传统的驼源纳米抗体具有非常相似的空间结构,而且n501可以同时与5T4抗原的8个富含亮氨酸的重复序列(Leucine-rich repeat,LRR)紧密结合,揭示了n501具有高稳定性及高抗原亲和力的分子机制。研究人员将全人源纳米抗体n501中第85位的丝氨酸突变为半胱氨酸,实现了小分子药物SN38的定点偶联,并将这类新型药物命名为全人源纳米抗体偶联药物(UdADC)。为了与基于单抗的传统ADC药物进行系统性比较,团队利用前期建立的全人源单抗研发平台,开发了一株针对相同靶点5T4的高亲和力全人源单抗m603,并利用传统的偶联技术将SN38偶联到m603上制备ADC。在体外的抗肿瘤细胞实验中,UdADC(n501-SN38)和ADC(m603-SN38)均能够有效的特异性杀伤5T4高表达的细胞系。因为全人源纳米抗体(13 kDa)比传统的IgG单抗(150 kDa)的分子量更小,研究发现UdADC具有优于传统单抗ADC的肿瘤组织穿透能力。在胰腺癌类器官模型与三维肿瘤微球模型中,UdADC的穿透深度均远优于基于传统单抗ADC(见图3),并能在肿瘤中更有效的累积,而传统单抗ADC则多停留在肿瘤球的浅表面。此外,在胰腺癌荷瘤小鼠模型中,UdADC在注射药物后的半小时内即可迅速定位到肿瘤部位并高效累积,因此能够更有效抑制小鼠肿瘤的生长,表现了更高效的抗肿瘤活性 [1]。
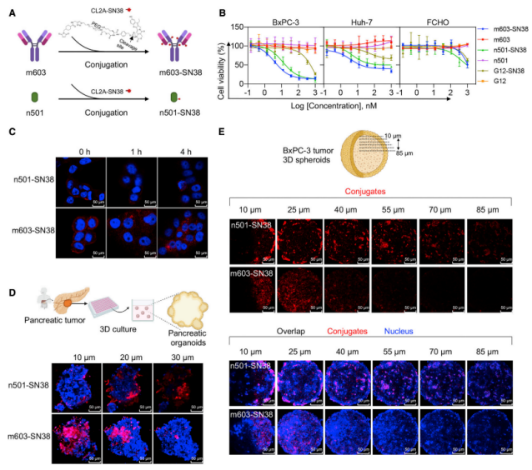
图3. UdADC在类器官和肿瘤微球中都有更好的肿瘤穿透性
此外,2021年9月3日,浙江大学药学院陈枢青教授与“百人计划”研究员潘利强研究员团队在Nature出版集团旗下期刊Signal Transduction and Targeted Therapy 在线报道了最新研究成果——“多价双表位抗EGFR纳米抗体-药物偶联物(multivalent biparatopic EGFR-targeting nanobody drug conjugate),用于恶性肿瘤的靶向治疗。研究团队通过抗体工程改造,将两种靶向EGFR的纳米抗体串联,并与细胞毒素定点偶联,制备了一款多价、双识别表位的纳米抗体偶联药物(见图4),由两种具备不同抗肿瘤活性机制的纳米抗体融合而成,因此表现比西妥昔单抗更优异的内吞效率,可更有效地将小分子毒素递送进入肿瘤细胞内部发挥作用。该新型ADC还可以克服临床上常见的因EGFR胞外区氨基酸点突变导致西妥昔单抗以及帕尼单抗耐药的一系列突变位点,具备较好的治疗应用前景[2]。
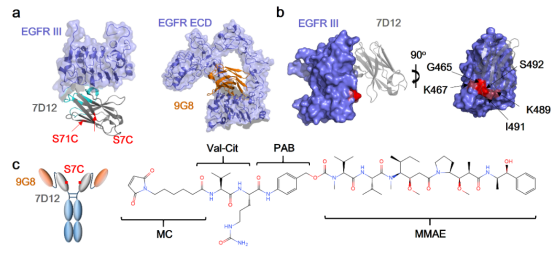
图4. EGFR的三维结构及纳米抗体ADC结构图
? 结 语
本文所述的ADC药物存在的组织穿透力差的问题,尤其对于实体瘤,是一个老生常谈的问题,回到ADC最基本的原理,将结合特异性的分子和高药效活性的分子偶联在一起,融合两个分子的结合特异性和高药效活性。从这样一个层面出发,重新认识ADC药物,我们一定要完整抗体吗?抛开固有的思维僵视,抗体部分我们完全可以选择抗体片段例如纳米抗体等来增强ADC药物的肿瘤渗透,但仍然面临一些潜在的问题,其中最大问题还是如何维持正常的DAR值以及半衰期短的问题。目前已经有一些可行的方案来有效的提高小分子抗体的半衰期,例如聚乙二醇化、多聚化、融合白蛋白或白蛋白结合域和融合Fc结构域。尽管ADC药物的研究已经迎来了爆发式发展,但还远没有到百花齐放的局面,ADC药物研发还有很多可能可以挖掘,期待更多创新的ADC药物分子走向市场。