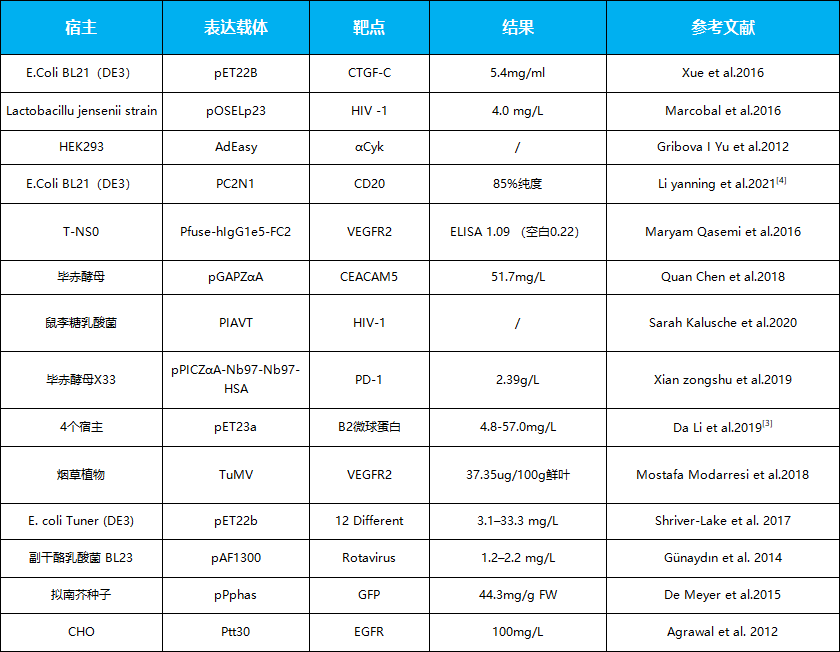
纳米抗体在不同系统中的表达
? 前 言
1993年比利时科学家在骆驼的血清中发现了一种与传统抗体结构不同的仅由重链可变区组成的新型抗体-纳米抗体(VHHs)。与传统抗体相比,纳米抗体理化性质稳定,免疫原性低,组织渗透能力强,能识别传统抗体不能识别的抗原表位等优点使其成为传统抗体的强有益补充。
纳米抗体仅由重链可变区组成,分子量小,结构简单,使其能在多种表达体系中实现稳定表达。到目前为止,VHHs已经在多种表达系统中表达,从原核细胞、酵母、真菌、昆虫细胞、哺乳动物细胞系到植物。本文主要介绍纳米抗体在不同表达系统中的表达,及在该系统领域中的现状及发展趋势。
原核表达系统 原核表达系统是最早被研究的非常成熟的蛋白表达系统,通过原核生物来获得外源蛋白,能够在较短时间内获得基因表达产物,而且所需的成本相对比较低廉。表达体系主要包括:大肠杆菌表达、枯草芽孢杆菌表达、链霉菌表达等。其中大肠杆菌系统应用最为广泛,一般所说的原核系统主要是指大肠杆菌表达。
大肠杆菌表达系统 大肠杆菌表达系统是实验室环境下重组蛋白最重要的表达平台,由乳糖操纵子控制表达。大肠杆菌系统宿主生长速度快,培养简单,价格低廉,遗传背景清楚,蛋白表达量高。但其不能对表达产物进行翻译后修饰,表达产物含大量内毒素且易形成包涵体。
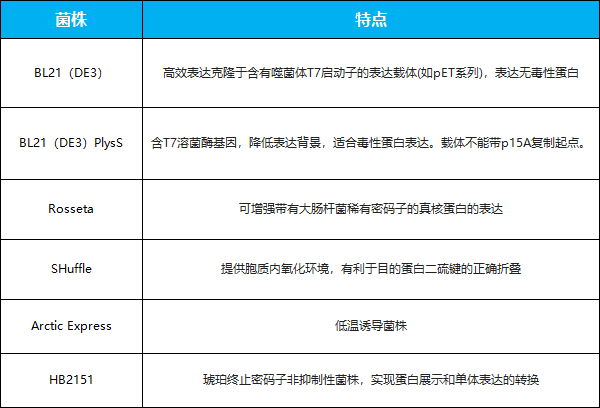
大肠杆菌表达系统常用宿主菌
周质空间作为大肠杆菌中唯一具有氧化环境的隔间,是含有特定二硫键的纳米抗体最常用的表达体系。除有氧环境外,周质空间还有许多伴侣和异构酶的存在,可以促进二硫键的正确形成,帮助蛋白质折叠。纳米抗体蛋白首先在细胞质间隙产生,然后再通过Sec途径、SPR途径或Tat途径分泌到周质空间,信号肽经信号肽酶切除后,可获得目的蛋白[1]。
截至目前,已有多个VHHs成功在周质表达,其中一些蛋白产量可达到数十毫克每升,但还有大量VHHs产量较低。这是因为许多融合蛋白不能有效地分泌在质周空间,细胞质表达似乎是这类融合蛋白的唯一表达方式[8]。
细胞质为还原状态隔间,使通过细胞质表达的蛋白不能经过正确折叠,多为包涵体蛋白,蛋白受保护而免受胞内酶的降解作用,易于以高纯度和高浓度形式分离。但细胞质中蛋白种类繁多,纯化难度大,同时,无功能包涵体蛋白需经过完全变性和重新折叠从这些包涵体中进行回收,但针对VHHs的回收通常是低效的[1]。 为了解决细胞质表达中的问题,Xue X等在2016年设计了一种新的透析-稀释设备,利用该设备,研究员重新折叠VHHs并达到85%回收率,而常规透析和稀释方法仅达到13%[9]。使用巯基氧化酶和二硫键异构酶活性的重组载体表达时,细菌细胞质可以成为产生正确折叠纳米体的有效隔间。更大的体积和更广泛的伴侣/折叠酶的细胞质可实现纳米抗体的高产量[6]。同时,在硫氧还蛋白和谷胱甘肽途径上都有缺陷的双突变株已经被开发出来。其中一些菌株近年来在商业上销售,如Origami (Novagen)、Rosetta-gami (Novagen)和SHuffle?T7 (New England Biolabs)等[10]。其中,SHuffle?T7过表达了一种临界质周异构酶DsbC,能有效催化二硫键异构化。一些研究发现,异构酶DsbC的活性可以增加细胞质周研究中功能性重组蛋白的产量[11]。
Kavousipour Soudabeh等改造载体加入4种不同的信号肽序列引导纳米抗体的分泌表达,并发现TrBC信号肽效果最好[5]。Jianli Yu等将丝素蛋白(SFP)中发现的重复氨基酸序列基序(GAGAGS)作为一种新型融合标签(SF-tag),以增强纳米小体在大肠杆菌中的表达。标记蛋白转录水平为未标记蛋白的2.3-7.0倍,产量增加了2.5-7.1倍[27]。Xi Xie等尝试选择抗冻蛋白AXX,通过合成XXA基因获得其反转录蛋白XXA,用于开发新的可溶性融合标签。实验发现XXA融合标签表达的融合蛋白可溶性比达到86%,远高于其他标签结果[12]。
其他原核表达系统 乳酸菌是最常见的肠道益生菌,一般认为它们对人体无害,很适合用于治疗性分子的生产宿主。但已有的表达数据显示,乳酸菌生产VHHS产量低,约为1-3mg/L,产量远低于大肠杆菌[13,14]。鼠李糖乳杆菌DSM14870作为人阴道中的正常菌群,可以可溶性或细胞壁锚固定的形式表达HIV抗体,是HIV抗体合适的表达宿主[2]。使用芽孢杆菌Brevibacillus choshinensis进行3L分批补料发酵时,产量高达3g/L[15]。此系统易于基因操作,无内毒素且表现弱蛋白酶活性,是非常值得关注的系统。
真核表达系统
由于原核表达系统具有包涵体蛋白不易纯化、蛋白修饰不完整等缺陷,人们开始利用真核细胞表达系统来研究基因。目前,基因工程 研究中常用的真核表达系统有酵母表达系统、昆虫细胞表达系统和哺乳动物细胞表达系统。
酵母表达系统 酵母系统遗传背景清楚,操作较为简便,容易进行遗传操作,有较为完善的真核蛋白表达控制系统,同时兼备原核和真核表达系统的优势。酵母真核蛋白表达系统有甲醇酵母表达系统,酿酒酵母表达系统,裂殖酵母表达系统以及克鲁维酸酵母表达系统等[17]。
酿酒酵母是第一种由人类发酵的酵母,无特异性病毒,成本低,是目前摇瓶培养产量最大的酵母表达系统,产量超过100mg/L[16]。VHHs某些氨基酸能参与内质网中分子伴侣的募集,从而缩小酿酒酵母与哺乳动物细胞分子伴侣机制的差异,有利于纳米抗体折叠动力学,提高纳米抗体在酿酒酵母中的产量[17]。酿酒酵母表达蛋白易发生超糖基化,发酵时产生大量内源性蛋白,目的蛋白分泌效率低[1]。考虑到以上问题,酿酒酵母渐渐被以毕赤酵母为代表的甲醇酵母替代。
巴斯德毕赤酵母表达系统是一种外源蛋白的高效表达系统,这种微生物不会积累有毒乙醇,只分泌很少内源性蛋白且其糖基化程度与哺乳动物细胞糖基化程度相同,免疫原性弱,因此是最常用的真核表达系统。毕赤酵母具有严格调控的甲醇可诱导AOX1启动子,适合外源蛋白的高表达[1]。但甲醇是高毒性、高危险性化工产品。利用不需要甲醇诱导的GAP启动子代替AXOI,培养过程中无需更换碳源,操作更为简便,可缩短外源蛋白到达峰值水平的时间。此系统产生的纳米体产量和亲和力与甲醇诱导表达产生的纳米体相当,已有研究使用本系统摇瓶表达纳米抗体产量达51.71mg/L[18]和16mg/L[19]。
真菌表达系统
一些丝状真菌,如木霉和曲霉属部分丝状真菌,能够在培养基中分泌大量的外源蛋白。但真菌体系除了表达感兴趣的蛋白质外,还产生许多蛋白酶,影响产量。Joosten 等在泡盛曲霉培养基中只获得1.5 mg/L的VHHs。添加0.25%的BSA后,达到7mg/L。据报道,与在该系统中高效分泌的内源性木聚糖酶相比,超过80%的VHH发生了降解或粘附在细胞壁上,研究人员认为VHHs分泌效率低是真菌表达的瓶颈[20]。为了克服这一限制并保护VHHs不被降解,其他研究人员将VHH与米根霉脂肪酶(N28)的高淀粉酶a信号序列(sTAA)和n端28氨基酸片段(N28)融合在一起,由此在米曲霉中表达的VHHs的最高产量达到73mg/L,低于大肠杆菌的产量300-800mg/L[21]。GlaB-VHH融合蛋白在米曲霉中的最终产量可达610mg/L,为纳米抗体高表达提供了可能,但稳定性尚待验证[22]。此外,还利用玉米黑穗病菌在非常规分泌途径中表达VHH[23]。
昆虫细胞表达系统
昆虫细胞是一种应用广泛的真核表达系统,重组杆状病毒载体(如AcMNPV)能够专一地转染昆虫细胞。其在自然界生存短暂,强启动子在哺乳动物中是失活的,不能感染脊椎动物,因此重组杆状病毒对人类具有安全性。强启动子控制下结构复杂蛋白可能来不及形成正确折叠及翻译后修饰,导致目的蛋白发生聚集,降低抗体产量,因此此系统中VHHs表达产量远高于其他类型抗体[17]。
Gómez-Sebastián等人首次使用改良杆状病毒表达系统(IBES?技术)表达VHHs。用不同重组杆状病毒接种法接种恙虫幼虫。从幼虫中提取的VHH收率为257 mg/L,纯化后回收率为50%[7]。针对表达抗内皮细胞选择蛋白时,用果蝇细胞SC-2分泌有12-14mg/L表达量,而同时用大肠杆菌表达则未检测到目的蛋白,这可能与昆虫细胞的加工修饰能力相关[26]。
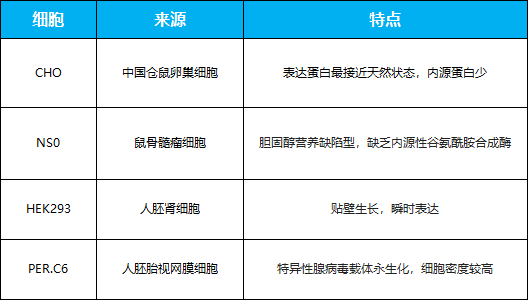
哺乳动物细胞表达系统 哺乳动物细胞是治疗性抗体的最佳表达系统,因为产生的抗体免疫原性最弱。目前最主要的细胞系包括CHO、NS0、Sp2/0、HEK293和PER.C6[17]。其中,CHO细胞生长迅速,适应无血清悬浮培养,是最受欢迎的寄主,它们能在摇瓶中表达高达100mg/L的VHHs[24]。HEK293细胞凭借瞬时转染和半稳定表达在实验室中更常用,因为它们需要更少的时间和劳动力。然而,被批准用于人类疾病治疗的单克隆抗体仅由CHO、NS0和SP2/0生产。因此,到目前为止,HEK293细胞还没有被用于生产VHHs,使用这种方法生产抗体片段的报道也很少[17]。大多数文献中采用CHO生产抗体片段,迄今为止,50%工业上生产的治疗性蛋白仍然由CHO生产[1]。与哺乳动物细胞系相关的生产成本远远高于与任何其他实验室研究平台相关的成本。
哺乳动物表达系统常用宿主细胞
植物表达系统 与其他表达系统相比,植物生产平台(稳定和瞬时表达系统)廉价、安全、能够折叠和组装复杂蛋白和翻译后修饰,易于扩展,且不受人类病原体和疾病的影响,是理想的蛋白质表达宿主,通常被用作哺乳动物表达系统的替代方法。除此之外,植物表达产物可集中在特定的器官如叶子或种子,可直接口服。烟草叶是表达VHHs最常见的寄主,而拟南芥和水稻种子表达蛋白因为可直接口服输入VHHs[1]而受到关注。植物系统表达常用的稳定转化方法存在重组基因逃逸到自然界或转基因耗时长等问题,因此有研究提出了植物病毒表达载体瞬时表达系统作为替代方法,正确构象的纳米体含量达可溶性蛋白总量的0.45%[25]。
纳米抗体表达现状及发展
大肠杆菌表达系统是纳米抗体最常用的表达体系,有周质和细胞质两个表达方式,各有利弊。一些氧化工程菌株已被改造,但需要更多的实验支撑。另有改造载体如添加标签或加入信号肽等各种方法被提出并已做一定实验验证。毕赤酵母与大肠杆菌相比,存在过度糖基化问题可能导致免疫原性,最终影响其临床应用。真菌,昆虫,植物和哺乳动物表达体系相对原核和真核表达体系复杂得多,从生产时间,成本和实验室条件等方面考虑后一般不轻易采用。
大肠杆菌系统快速、方便、廉价,是大多数实验室条件下VHH表达的首选。当某些类型的VHHs无法在大肠杆菌中成功生产时,就会使用其他系统作为替代。
纳米抗体表达情况一览表