市值蒸发近180亿!连花清瘟研发只花了15天?以岭药业发声!还回应这5点争议
原标题 市值蒸发近180亿!连花清瘟研发只花了15天?发声!还回应这5点争议——
北京商报
 从王思聪喊话证监会“严查”,到丁香医生发表《不要吃连花清瘟预防新冠》,再到王思聪微博被禁言……最近,连花清瘟和以岭药业成为行业内外关注的焦点。
从王思聪喊话证监会“严查”,到丁香医生发表《不要吃连花清瘟预防新冠》,再到王思聪微博被禁言……最近,连花清瘟和以岭药业成为行业内外关注的焦点。
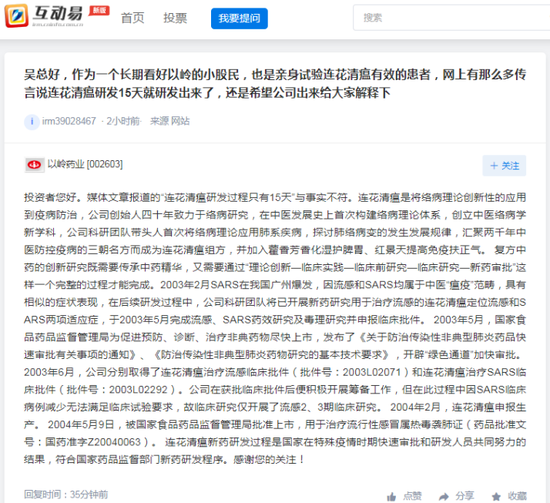
4月20日,以岭药业股价报收于29.27元,下跌9.69%。自4月14日王思聪发微博质疑以来,以岭药业的总市值已经蒸发了近180亿元。同时,新一轮舆论风暴围绕“连花清瘟研发过程只有15天”的传言展开了。
20日,以岭药业举行媒体说明会,再度回应近期网络舆情。以岭药业表示,公司已经保留证据,并向相关部门报案。
研发只花15天?
以岭药业:不实
以岭药业相关舆论一波未平一波又起,最近,有媒体报道“连花清瘟研发一共只用了15天”,讨论度越来越大。18日开始,不断有投资者在互动平台向以岭药业询问相关事项。

 据查询,这一说法或许源自2004年6月30日《中国中医药报》第2168期的一篇文章——《在血与火的洗礼中绽放科技之花——连花清瘟胶囊研发纪实》。这篇文章中,有这样的表述:
据查询,这一说法或许源自2004年6月30日《中国中医药报》第2168期的一篇文章——《在血与火的洗礼中绽放科技之花——连花清瘟胶囊研发纪实》。这篇文章中,有这样的表述:
“他们昼夜攻关,在短短的15天内完成了“连花清瘟胶囊”的提取、浓缩、干燥、成型等生产工艺和质量标准的研究工作,并不断完善,使之符合高标准的生产要求。”
“连花清瘟胶囊从研制到获省药监局批号,再到进入国家食品药品监督管理局药品快速审批通道,仅用了一个月的时间,这确实是一个奇迹。”
20日,以岭药业在深交所互动易平台回应投资者称,媒体文章报道的“连花清瘟研发过程只有15天”与事实不符。
以岭药业主要谈了以下几点:
1. 复方中药的创新研究既需要传承中药精华,又需要通过“理论创新—临床实践—临床前研究—临床研究—新药审批”这样一个完整的过程才能完成。
2:从时间线看,连花清瘟于2003年5月完成流感、SARS药效研究及毒理研究并申报临床批件;2003年6月,取得了连花清瘟治疗流感临床批件(批件号:2003L02071)和连花清瘟治疗SARS临床批件(批件号:2003L02292);2004年2月,连花清瘟申报生产;2004年5月9日,被国家食品药品监督管理局批准上市,用于治疗流行性感冒属热毒袭肺证(药品批准文号:国药准字Z20040063)。
3. 连花清瘟新药研发过程是国家在特殊疫情时期快速审批和研发人员共同努力的结果,符合国家药品监督部门新药研发程序。
 “已保留证据并报案”
“已保留证据并报案”
媒体会上回应5大热点问题
4月20日,以岭药业盘中触及跌停,收跌9.69%,股价自4月12日高点至今已跌去3成,自4月14日收盘至20日收盘,以岭药业的总市值已经蒸发近180亿元。
 据上海证券报,4月20日下午,以岭药业举行媒体公开说明会,公司高管回应了连花清瘟临床研究、不良反应及禁忌症等5大舆论热点问题。
据上海证券报,4月20日下午,以岭药业举行媒体公开说明会,公司高管回应了连花清瘟临床研究、不良反应及禁忌症等5大舆论热点问题。
以岭药业董秘吴瑞表示,会持续跟踪事态发展情况,对于一些诋毁公司、发布不实信息的行为,公司已经保留证据并向相关部门报案,将通过法律手段维护自身合法权益。
热点一:
连花清瘟未做双盲实验?
吴瑞说:“随机双盲多中心、随机分组多中心、真实世界研究等都是界认可的药物临床评价方法,针对不同病种、不同情况、不同阶段,可以采取其中任何一种研究方法,结果都是具有科学价值的,连花清瘟从研发上市至今近20年,是国内开展临床评价研究最多的创新中药之一。”
据了解,2003年,连花清瘟胶囊治疗流感随机双盲、对照、多中心3期临床试验由中国中医科学院广安门医院等4家医院,试验过程严格按照《药品注册管理办法》及GCP要求进行质量控制和规范进行,结果证实连花清瘟显著改善流感样症状。
2009年,连花清瘟胶囊随机双盲、多中心与奥司他韦对照治疗甲型H1N1流行性感冒临床研究由首都医科大学附属佑安医院联合8家医院共同完成。试验结果证明:连花清瘟在病毒核酸转阴时间方面与奥司他韦相当,退热时间连花清瘟优于奥司他韦,明显减少了疾病的严重程度和症状的持续时间,治疗费用仅相当于奥司他韦的1/8,显示出综合干预优势。
2020年,连花清瘟开展了治疗新冠肺炎前瞻性、随机、对照、多中心临床研究。
由于新冠疫情刚暴发,其发病规律、预后与死亡尚不明确,专家组讨论认为,采取双盲、安慰剂对照不能保障病人生命安全,因此专家组决定采取随机、对照、多中心研究方法。该研究由武汉大学人民医院等全国9个省23家医院共同完成,由第三方CRO公司负责监查和质量控制,第三方统计单位完成数据管理和统计分析,保证其客观性与科学性。研究结果证实:连花清瘟治疗组的主要临床症状(发热、乏力、咳嗽等)改善率较对照组显著提高,症状持续时间明显缩短,临床治愈率有效提升。该论文发表于国际知名植物医学期刊《Phtomedicine》。
2020年4月,国家药品监督管理局批准连花清瘟胶囊/颗粒在原批准适应症的基础上,增加“新型冠状病毒肺炎轻型、普通型”的新适应症。
公司表示,2022年,连花清瘟治疗轻、中度COVID-19患者有效性和安全性的随机、双盲、国际多中心临床研究正在进行中,国内相关后续研究也正在开展中。
热点二:
连花清瘟是不是“新冠肺炎用药”?
资料显示,连花清瘟药品说明书中的功能主治为:清瘟解毒,宣肺泄热。用于治疗流行性感冒属热毒袭肺证,症见发热,恶寒,肌肉酸痛,鼻塞流涕,咳嗽,头痛,咽干咽痛,舌偏红,苔黄或黄腻。在新型冠状病毒肺炎的常规治疗中,可用于轻型、普通型引起的发热、咳嗽、乏力。
吴瑞表示,2020年4月,国家药品监督管理局批准连花清瘟功能主治增加“在新型冠状病毒性肺炎的常规治疗中,可用于轻型、普通型引起的发热、咳嗽、乏力”。
国内新冠疫情发生后,2020年1月27日,国家卫生健康委员会办公厅、国家中医药管理局办公室联合发布的《新型冠状病毒感染的肺炎诊疗方案(试行第四版)》中,首次将连花清瘟列为中医治疗医学观察期推荐用药。
之后发布的《新型冠状病毒肺炎诊疗方案(试行第五/六/七/八版)》继续将连花清瘟列为中医治疗医学观察期推荐用药。2022年3月14日发布的《新型冠状病毒肺炎诊疗方案(试行第九版)》中,除将连花清瘟继续列为中医治疗医学观察期推荐用药外,还将其列为临床治疗期(确诊病例)轻型和普通型推荐用药。
“公司一直严格按照国家药监局批准的连花清瘟适应症进行市场推广。”吴瑞说。
其表示:“在多年的应用实践中,临床专家一直在对连花清瘟的临床应用开展新的研究。2021年河北医科大学附属第二医院主持开展了连花清瘟对新冠肺炎密切接触者1976例前瞻性、开放标签、对照试验,研究结果证实:连花清瘟干预组核酸检测阳性率0.27%显著低于对照组阳性率1.14%(具有统计学意义),密接人群预防应用连花清瘟可降低新冠肺炎阳性感染率达76%,同时安全性良好。该项研究结果发表于《Evidence-Based Complementary and Alternative Medicine》。”
热点三:
连花清瘟不良反应和禁忌不明确?
公司表示,媒体文章中称“连花清瘟药品说明书中关于不良反应和禁忌的描述一直不明确”的说法与事实不符。
2019年3月,公司已根据《药品注册管理办法》、《中成药非处方药说明书撰写指导原则》的规定,对连花清瘟胶囊说明书的“不良反应”、“禁忌”项向药品监管部门提出了修订。其中【不良反应】修订为“上市后监测数据显示本品可见以下胃肠道不良反应如恶心、呕吐、腹痛、腹泻、腹胀、反胃,以及皮疹、瘙痒、口干、头晕等”,【禁忌】修订为“对本品及本品成分过敏者忌服”。
公司进一步表示,作为已上市近20年的中成药,连花清瘟具有良好的安全性,根据国家药品不良反应监测系统数据显示,不良反应发生率属于国际医学科学组织委员会(CIOMS)推荐定义的“非常罕见”级别。
热点四:
世卫组织“推荐”连花清瘟?
吴瑞说:“经公司自查,公司方面无人接受过某微博自媒体发布视频中所提到的两家媒体采访,也未在任何场合表示世卫组织‘推荐’连花清瘟。”
吴瑞表示,世界卫生组织日前发布《世界卫生组织中医药救治新冠肺炎专家评估会报告》(以下称“评估报告”),该报告明确肯定了中医药救治新冠肺炎的有效性和安全性,鼓励世卫组织会员国在其卫生保健系统和监管框架内考虑使用中医药治疗新冠的可能性。
评估报告指出,研究结果表明中医药能有效治疗新冠,且根据临床疗效判定指标显示对轻型和普通型病例尤其有效,有利于降低轻型或普通型病例转为重症的风险。对于轻型与普通型病例,与单纯的常规治疗相比,中医药在作为附加干预措施时,可缩短病毒清除时间、临床症状缓解时间和住院时间。在进行常规治疗的同时,使用中医药方法进行干预,不仅耐受性良好,其安全性与单纯的常规治疗亦相仿;尽早使用中医药可改善轻型和普通型新冠肺炎患者的临床预后。同时,评估报告建议开展新的临床研究。
在中方专家分享的关于中医药救治新冠肺炎的相关报告中,引用了发表在《植物医学》(Phytomedicine)上的《中药连花清瘟胶囊治疗新型冠状病毒肺炎前瞻性、随机、对照、多中心临床研究》(Efficacy and Safety of Lianhuaqingwen capsules, a Repurposed Chinese Herb, in Patients with Coronavirus Disease 2019: a Multicenter, Prospective, Randomized Controlled Trial)的相关研究成果(报告第8页)。
“综上,《世界卫生组织中医药救治新冠肺炎专家评估会报告》认可的是包含连花清瘟在内的中医药对于新冠肺炎的疗效。公司未在任何场合表示世卫组织‘推荐’连花清瘟。”吴瑞说。
热点五:
贾振华作为相关临床研究论文共同作者是否影响研究结果?
吴瑞表示,发表在《植物医学》(Phytomedicine)上的《中药连花清瘟胶囊治疗新型冠状病毒肺炎前瞻性、随机、对照、多中心临床研究》论文署名作者共19位,贾振华教授仅是其中的一员。在该项临床试验中,他主要负责研究方案设计,但并未参与数据收集和统计分析,未对研究结果造成任何影响。公司向该研究提供部分资金及研究药物等事宜均已由《Phytomedicine》编辑部进行了澄清并可公开查阅。
该项临床试验是由全国9个省23家医院共同完成的前瞻性、随机对照、多中心循证研究,由第三方CRO公司负责数据收集、监查和质量控制,数据管理和统计分析也由第三方统计单位完成,从而保证了该项临床研究的客观性与科学性。
吴瑞还表示,目前,以岭药业科研、生产、经营一切正常。