韩林、王敏教授等:原儿茶酸通过Toll样受体4/核因子κB途径减轻高脂
随着现代生活方式的改变,大量高糖和高脂饮食的摄入可引起机体肥胖,导致全身慢性炎症,其中在肝脏中发生的代谢性炎症尤为明显。肝脏是机体调控糖脂代谢的中心,炎症会破坏肝细胞正常代谢并损害其中的胰岛素信号传导。原儿茶酸(protocatechuic acid,PCA)是花青素在体内的主要代谢产物之一,在体内外均显示出积极的抗炎活性。然而,目前PCA对肝脏炎症的改善作用及其机制研究较少
西北农林科技大学食品科学与工程学院焦小文、韩林*、王敏*等分析PCA在体外和体内改善高脂饮食(HFD)或棕榈酸(PA)诱导的小鼠肝脏炎症的效果。此外,通过体外转录组测序(RNA-Seq)进一步揭示PCA的抗炎机制。

1.PCA干预对C57BL/6J小鼠的体质量、空腹血糖、OGTT和ITT水平的影响
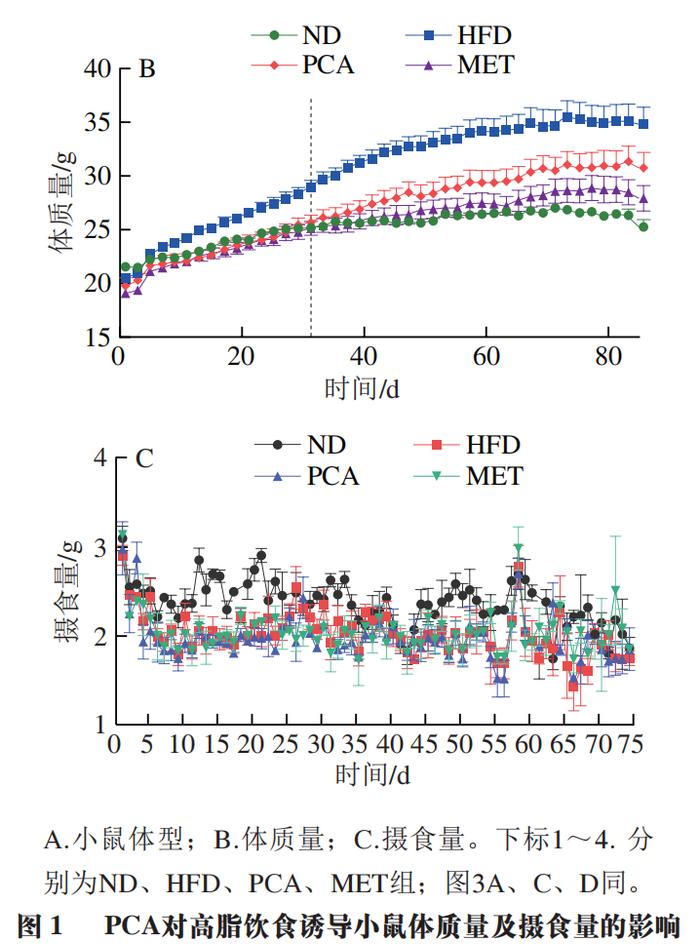
PCA对高脂饲喂小鼠体质量的影响如图1所示。与ND组相比,HFD组小鼠体型更加肥胖,而与HFD组相比,PCA组小鼠体型明显改善(图1A)。干预前4 周,各处理组小鼠体质量没有明显差异,干预第5周,HFD组小鼠的平均体质量((30.32f2.11)g)明显高于ND((25.72f1.01)g)和PCA组((26.97f1.91)g),此后维持此趋势至实验结束(图1B)。干预12 周时,HFD组小鼠体质量增长率为45.8%,比ND组小鼠体质量增长率高25.9%,PCA组小鼠体质量增长率比HFD组小鼠低16.9%,同样,阳性对照药物MET对小鼠体质量的影响与PCA相似。
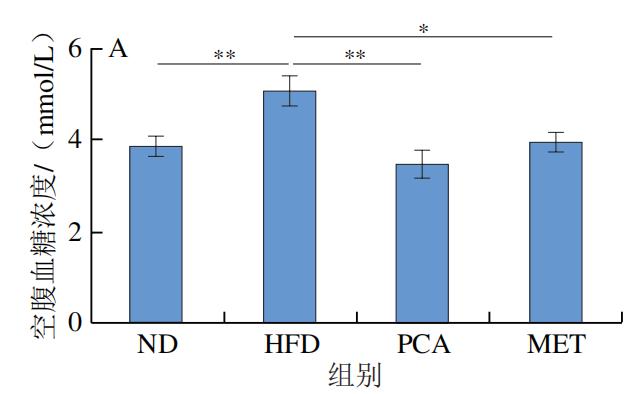
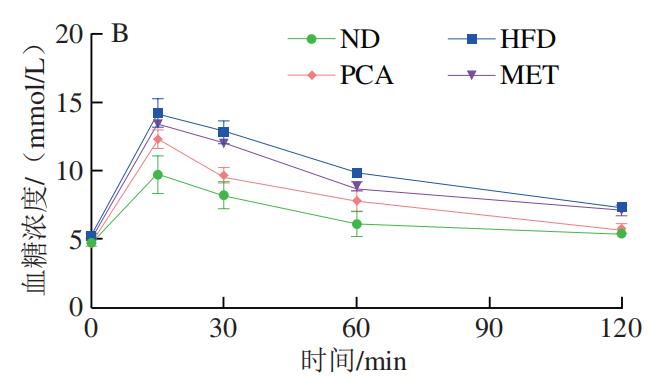
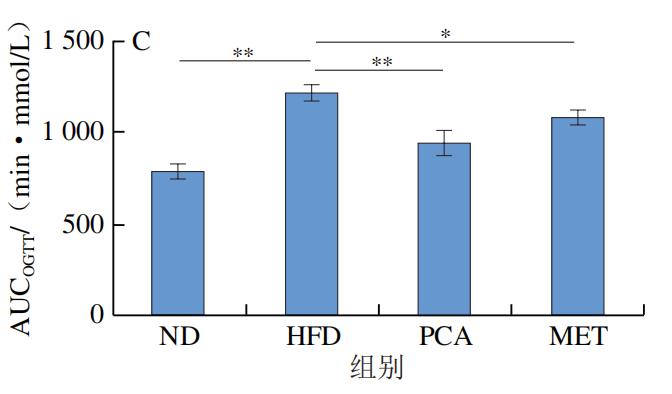
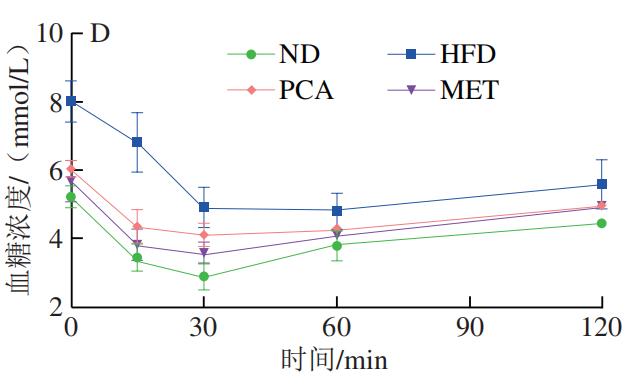
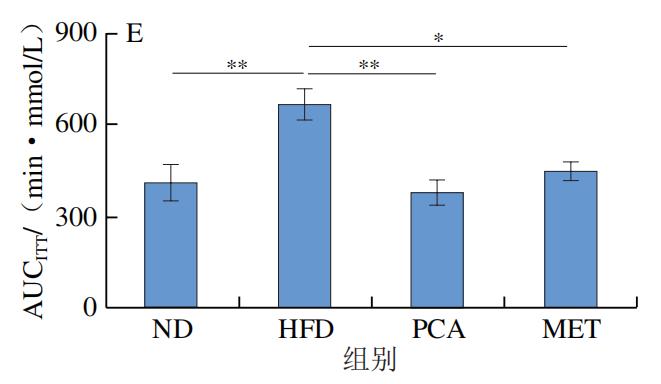
如图2A所示,与HFD小鼠相比,PCA组及ND组小鼠空腹血糖浓度具有极显著差异(P<0.01),说明膳食补充PCA在降低空腹血糖浓度方面具有显著效果。如图2B、C所示,口服葡萄糖后,与ND组小鼠相比,HFD小鼠血糖浓度在测定时间段内难以恢复至正常水平,与HFD组比较,膳食补充PCA的小鼠血糖浓度恢复正常的时间相对接近ND组,说明膳食补充PCA在针对葡萄糖耐量稳定方面具有明显作用效果。同时,本实验研究了PCA对高脂小鼠ITT的影响,结果如图2D、E所示,经过胰岛素干预后,HFD组小鼠的血糖浓度下降,但与正常组小鼠相比差异明显,与HFD组相比,PCA组小鼠调节血糖浓度的能力显著增强。由AUCOGTT、AUCITT分析结果可知,相比ND组,HFD组小鼠AUC极显著增加(P<0.01);与HFD组相比,PCA能够极显著改善小鼠胰岛素反应的迟钝性(P<0.01),且改善效果优于MET。以上结果表明通过膳食的补充PCA能够提高小鼠胰岛素敏感性。

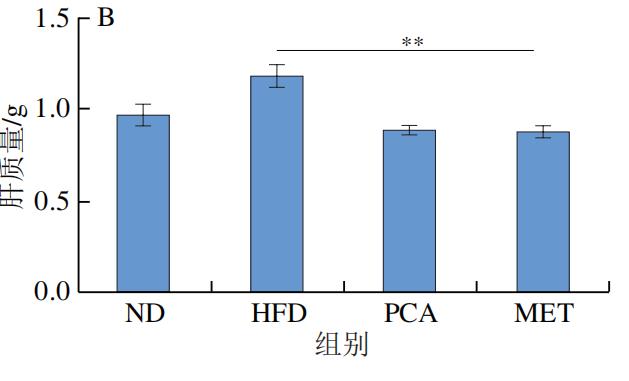
2.PCA干预对C57BL/6J小鼠肝脏质量和脂肪积累的影响
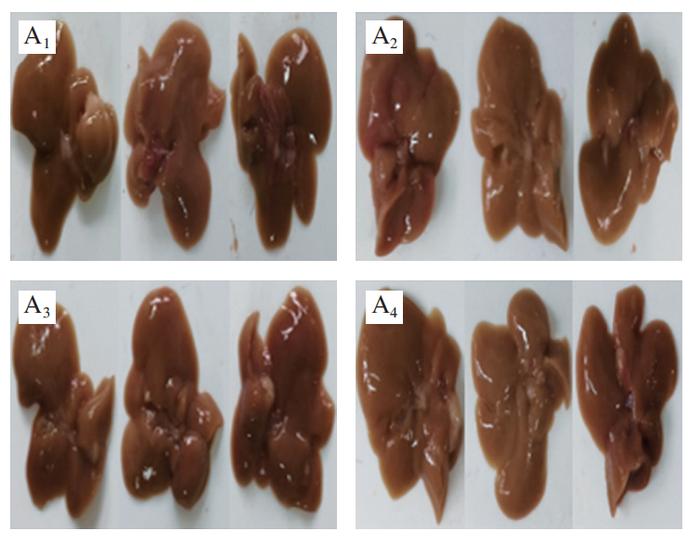
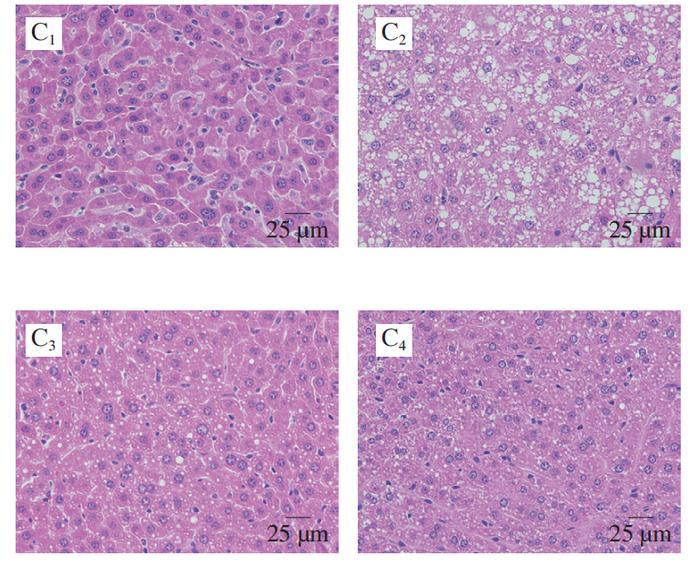
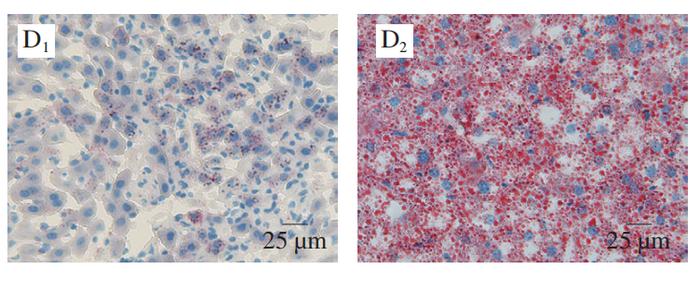
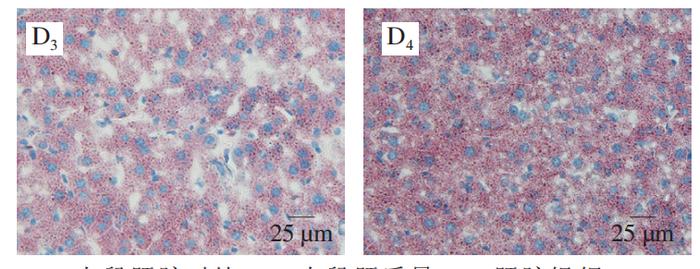
肝脏在调节血糖方面起着关键作用,当机体处于饥饿状态时,肝脏通过合成糖原来响应胰岛素信号或糖原分解。然而,HFD引起的过量能量供应会导致脂肪在肝脏中的异位沉积以及炎症反应和胰岛素抵抗。如图3A、B所示,HFD组的肝脏体积、质量明显大于其他组。H&E染色(图3C)和油红O染色(图3D)结果进一步显示,HFD处理的C57BL/6J小鼠肝脏中形成大量脂滴,但PCA明显抑制肝脂肪的积聚,这可能与胰岛素抵抗的改善密切相关。

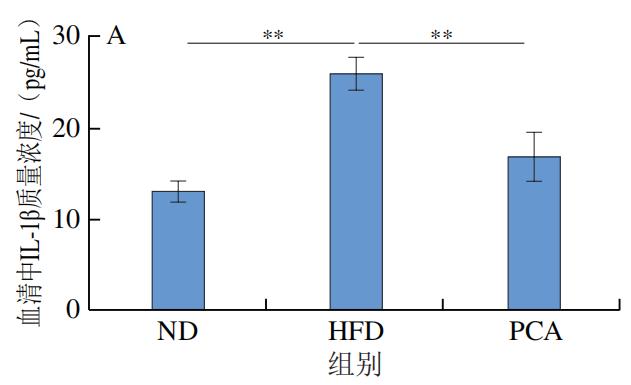
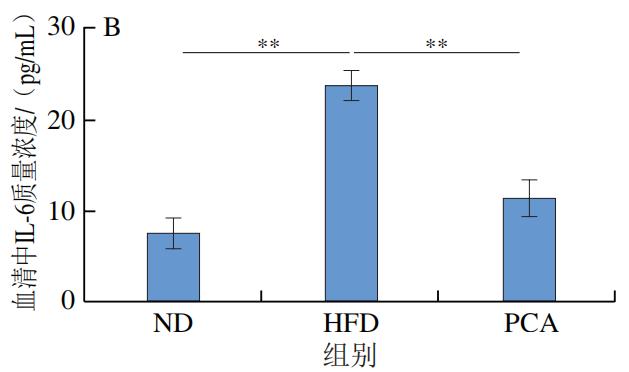
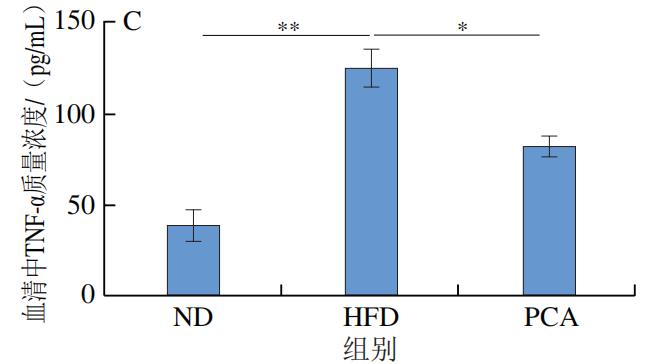
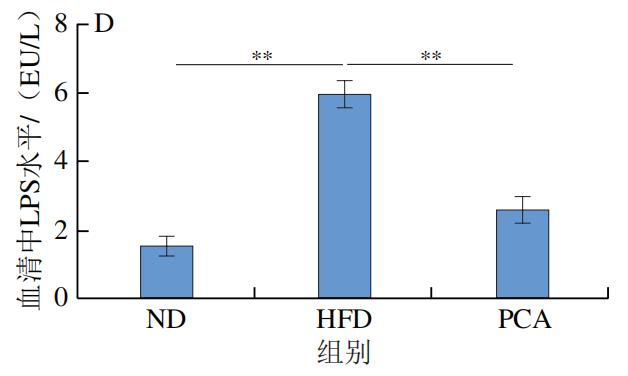
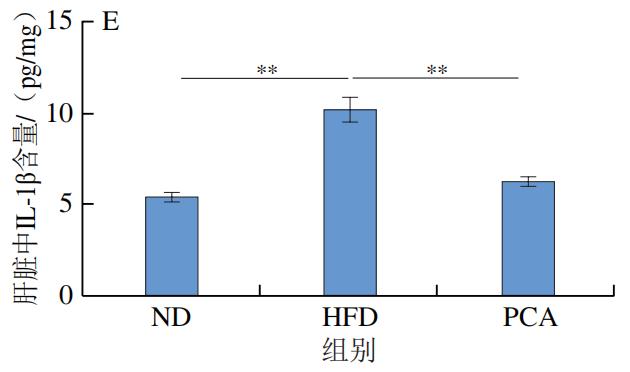
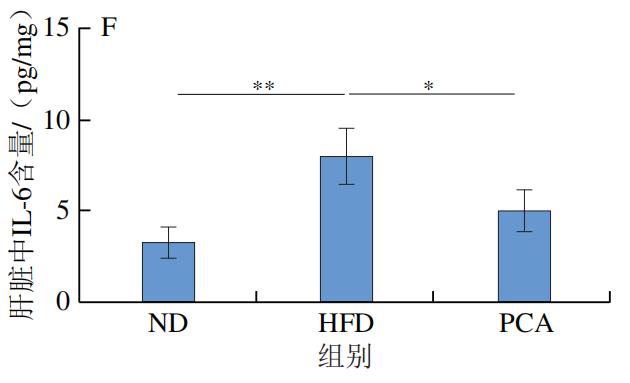
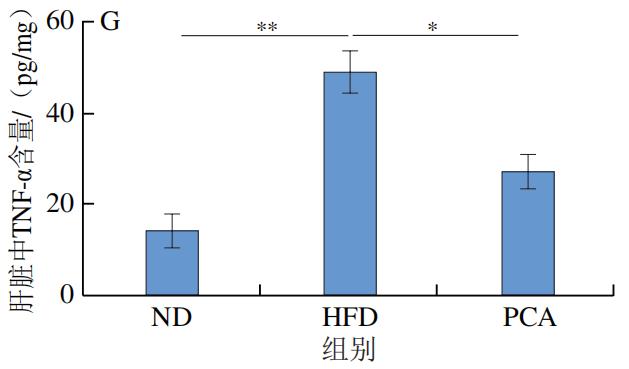
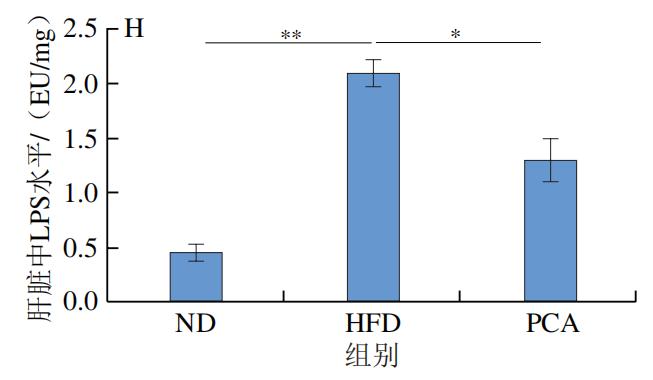
3.PCA干预对C57BL/6J小鼠血液和肝脏中炎症因子及LPS水平的影响
如图4所示,干预12 周后,HFD极显著增加了C57BL/6J小鼠血液和肝脏中的炎症标志物IL-1β、IL-6、TNF-α和LPS的水平(P<0.01);与HFD组相比,PCA干预显著降低了血液和肝脏中IL-1β、IL-6、TNF-α和LPS的水平(P<0.05、P<0.01)。以上结果表明,摄入PCA可有效改善HFD诱导的肝脏炎症反应。

4.RNA-Seq分析结果和实时荧光定量PCR验证结果
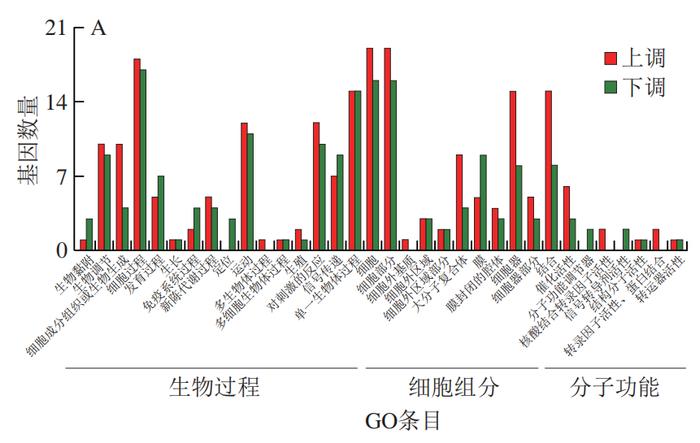
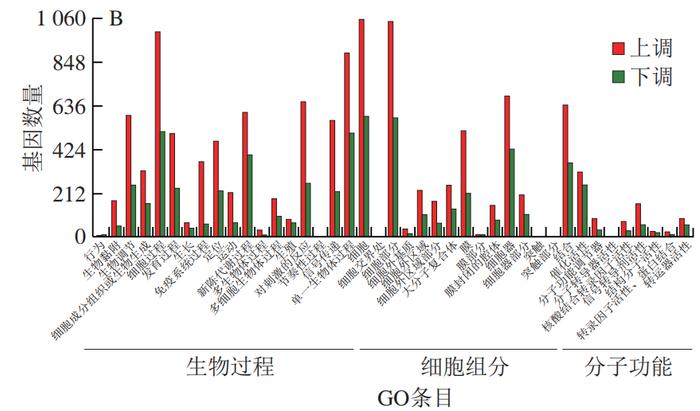
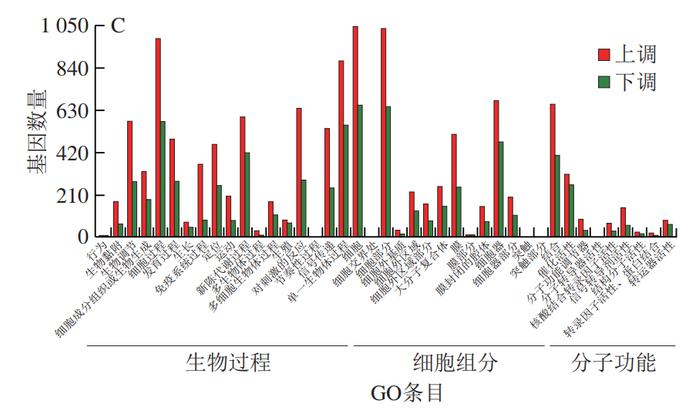
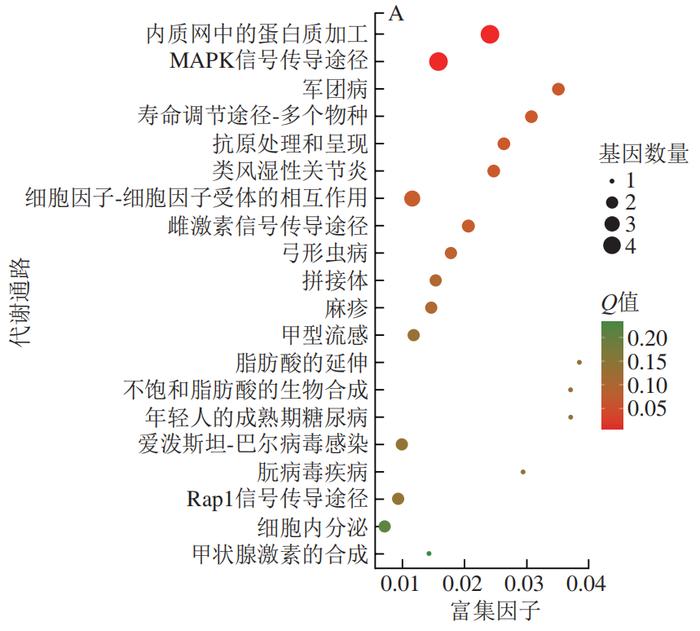
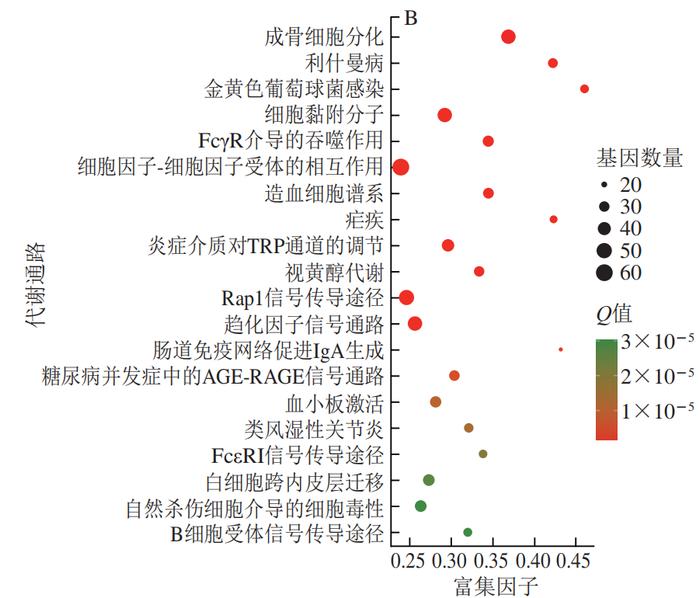
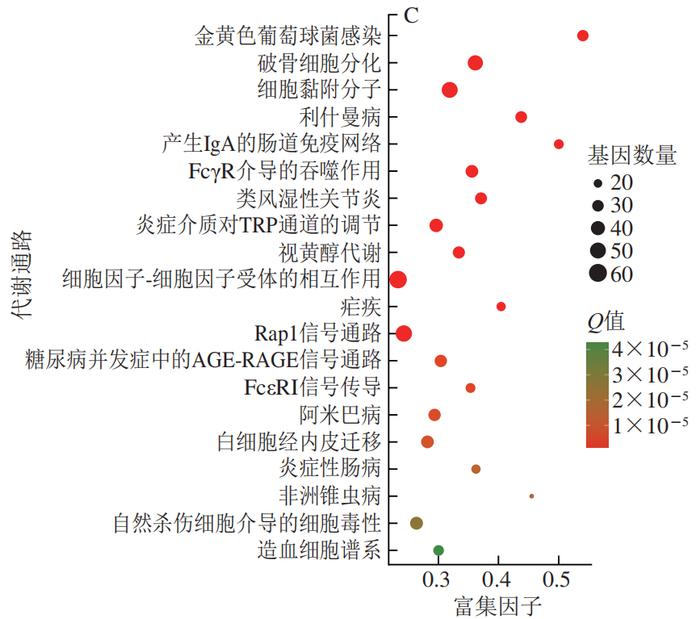
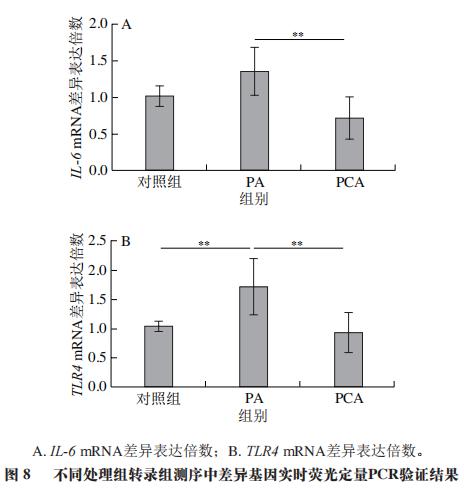
为了进一步揭示PCA改善HFD诱导小鼠肝脏炎症的分子机制,从C57BL/6J小鼠的肝脏中分离鉴定了原代肝细胞(图5)。经RNA-Seq分析共发现4 724 个DEGs,本研究利用GO富集分析对差异表达的基因进行分析。经过比对GO条目(FDR≤0.05且P≤0.05)发现,排名较前的GO条目大多富集在细胞代谢进程调控的途径(图6)。KEGG分析结果显示DEGs在许多信号通路中富集,如内质网中的蛋白质加工、MAPK信号通路和破骨细胞分化等(图7)。选取2 个DEGs(IL-6、TLR4)验证各组mRNA表达的变化,发现与PC组相比,PCA处理可极显著降低炎症细胞因子标记基因IL-6的表达(P<0.01)(图8A),与RNA-Seq分析结果相互印证;TLR4水平与机体的炎症反应密切相关,经PCA处理后,TLR4表达水平极显著降低(P<0.01)(图8B)。


5.PCA干预对TLR4和MyD88蛋白表达的影响
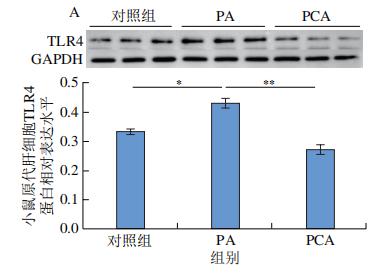
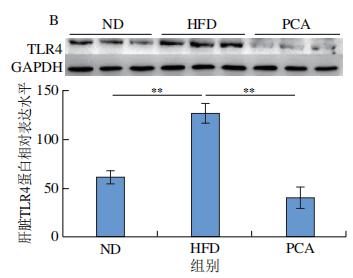
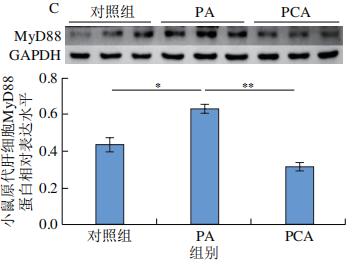
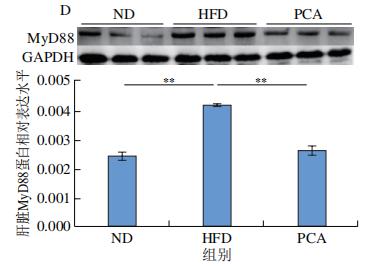
通过RNA-Seq分析发现PCA可以明显抑制TLR4 mRNA的表达,免疫印迹分析进一步证实了这一结论,即PCA处理C57BL/6J小鼠的原代肝细胞和PCA干预12周小鼠肝脏中TLR4的蛋白表达水平均显著降低(图9A、B)。MyD88在激活后被募集到TLR4的Toll/IL-1受体域,这种相互作用触发了NF-κB信号通路的激活。如图9C所示,PA处理明显促进小鼠原代肝细胞中MyD88的蛋白表达,但与100μmol/L PCA共孵育24 h后,这种现象被逆转(图9C)。此外,饲喂HFD的C57BL/6J小鼠中进一步观察到了这一现象(图9D),表明饱和脂肪酸可以激活TLR4/MyD88通路,但在体外和体内与PCA共同处理可抑制TLR4/MyD88通路的激活。

6.PCA干预对体外和体内p-NF-κB、NF-κB和IL-6表达的影响
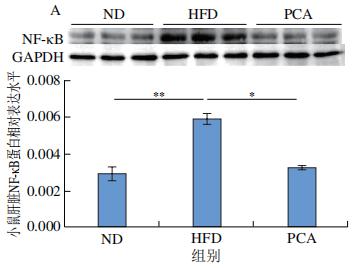
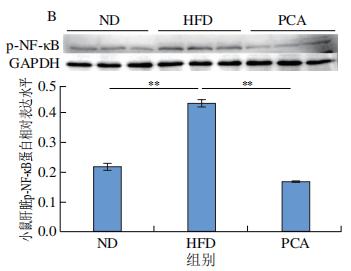
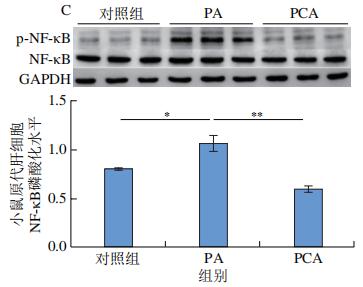
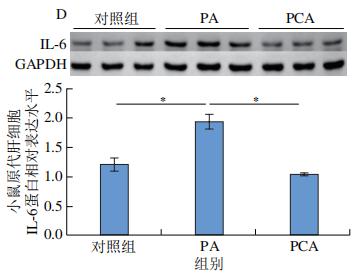
作为TLR4的下游靶蛋白,NF-κB可以在刺激TLR4后通过促进磷酸化来激活。NF-κB信号通路是一种炎症性通路,正常情况下IκB-α蛋白与NF-κB二聚体结合并呈非活性形式,NF-κB的激活可介导TNF-α、IL-6等炎症因子表达。如图10A、B所示,与ND组相比,HFD组小鼠饲喂12周后,肝脏NF-κB、p-NF-κB蛋白表达水平极显著增加(P<0.01);与HFD组相比,PCA干预可以显著或极显著抑制NF-κB、p-NF-κB蛋白表达(P<0.05、P<0.01)。通过PA刺激24 h会显著增加小鼠原代肝细胞中NF-κB的磷酸化水平(P<0.05)(图10C),而PCA处理可以极显著抑制PA刺激原代肝细胞NF-κB的磷酸化水平(P<0.01),同时可以显著抑制炎症生物标志物IL-6的表达(P<0.05)(图10D)。以上结果表明,PCA可通过抑制肝脏p-NF-κB的表达,有效改善HFD诱导的肝脏炎症。

讨 论
大量流行病学研究表明,膳食摄入花青素可以有效改善体内炎症反应。PCA作为花青素在体内的主要代谢产物,也表现出较强的抗炎活性。在本研究中,PCA可以有效减少HFD诱导的C57BL/6J小鼠体质量增加和肝脏脂肪积聚(图1、3),并减轻胰岛素抵抗和改善体内葡萄糖稳态(图2)。炎症可能是肥胖相关胰岛素抵抗的最重要诱因之一,尤其是在肝脏中。本研究结果表明,PCA治疗可显著降低血清和肝脏中的炎症因子水平,如IL-1β、IL-6、TNF-α和LPS(图4)。综上所述,100 mg/(kgmbgd)PCA干预12 周可有效改善HFD诱导的C57BL/6J小鼠肝脏炎症。
随后,为了研究PCA改善肝脏炎症的作用机制,本实验采用RNA-Seq研究PCA对小鼠原代肝细胞RNA转录的影响。与课题组之前在内皮细胞中所得到的结果相似,不同治疗组之间共发现4 724 个DEGs。在这些DEGs中,筛选并发现PA处理组中TLR4的基因高度表达,但这种现象可通过PCA处理实现逆转(图9)。免疫印迹分析进一步证实了这些结果(图10)。TLR4蛋白在LPS或饱和脂肪酸诱导的炎症反应中发挥着至关重要的作用。通过RNASeq分析发现,PCA处理明显抑制了TLR4的基因和蛋白表达,这可能是PCA抗炎活性的关键机制。
典型的MyD88依赖性和非典型的MyD88非依赖性信号通路是TLR4途径的主要类型,可诱导效应基因的表达,如NF-κB。MyD88可以随着TLR4表达的增加而被招募,然后在各种炎性细胞因子的诱导下,通过促进磷酸化激活NF-κB。因此,HFD或PA诱导的C57BL/6J小鼠肝脏和原代肝细胞中TLR4的高表达伴随着MyD88和p-NF-κB水平的增加(图9、10)。然而,PCA干预显著抑制了MyD88和p-NF-κB的表达,从而明显减少炎症标记物IL-6的生成(图9、10)。
综上所述, PCA干预可显著降低HFD饲喂C57BL/6J小鼠血清和肝脏中的炎症因子水平,并通过TLR4/MyD88/NF-κB信号通路在体内外表现出有效的抗炎活性。TLR4作为膜识别受体,可识别病原体如LPS、细胞内毒素等物质,PCA可能通过降低血清及肝脏中LPS的水平,从而抑制TLR4的表达,然而,PCA抑制TLR4表达的确切机制目前尚不明确,需要进一步研究
本文《原儿茶酸通过Toll样受体4/核因子κB途径减轻高脂饮食诱导的肝脏炎症》来源于《食品科学》2023年44卷第9期72-81页,作者:焦小文,李 佳,李云龙,韩 林,王 敏。DOI:10.7506/spkx1002-6630-20220620-204。