《2022血液大咖谈》第二十二讲|探索高风险弥漫性大B细胞淋巴瘤的精准诊疗之路
血液病是常见的临床疾病,包括淋巴瘤、多发性骨髓瘤、血友病等,但在实际工作中,由于医疗资源分布不均等原因叠加,血液病的诊治仍存在一定的困难。为提高血液病的诊断率与治疗率,推广规范化治疗理念与实践,加强血液病工作者之间临床诊疗规范和科研能力的学术交流,神州细胞工程有限公司联合健康界策划推出《血液大咖谈》线上直播课程。
2022《血液大咖谈》栏目延续既往分享宗旨,全新升级重磅归来,健康界非常荣幸地邀请到了内蒙古包头肿瘤医院王亚兰教授作为主席,大连医科大学附属第一医院孙国珍教授作为分享嘉宾,于9月20日在线直播分享了“高风险DLBCL精准诊疗之路”。
 图1: 《2022血液大咖谈》第22期直播
图1: 《2022血液大咖谈》第22期直播
具有高度侵袭性的弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)是非霍奇金淋巴瘤的一种常见类型,不同亚型的患者在临床表现、生物学特性、治疗反应及预后方面均表现出明显异质性,有约40%患者在接受标准一线免疫化疗R-CHOP方案(利妥昔单抗、环磷酰胺、阿霉素、长春新碱、强的松)治疗后出现初治耐药/难治或病灶消退后短期复发,这部分具有高危因素的患者需要进一步分层,从而为精准靶向药物的选择提供参考依据,这同时也是目前DLBCL治疗最关键、最难的探索热点。
识别高危人群的工具
如何识别这类具有高危因素的患者? IPI评分、细胞来源、FISH检测、基因分类都是目前临床可用工具。其中经典的IPI(淋巴瘤国际预后评分)于1993年提出后沿用至今,2014的NCCN-IPI和2017年GELTAMO-IPI为改良版本,三版都包含年龄、Ann Arbor分期,β-2微球蛋白、结外侵犯等临床生化变量,在年龄的细分和预测分层方面有些许差异,在预后方面具有实用性。孙国珍教授指出,IPI评分应用虽广,但尚未纳入细胞起源、双/三打击MYC重排、增殖指数和TP53突变等一些和预后有明显关联的生物学因素。
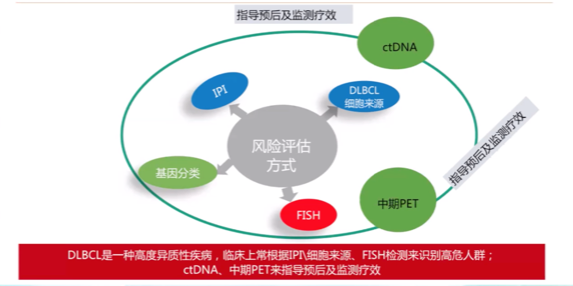
图2: 识别DLBCL高风险人群的工具
根据DLBCL细胞来源,因生发中心B细胞样(germinal center B-cell-like,GCB)亚型对CD20更敏感,其预后相较活化 B 细胞样(activated B-cell-like,ABC)型更好,GOYA研究显示,ABC型与GCB型相比,3年无进展生存(progression-free survival, PFS)降低15%~20%。
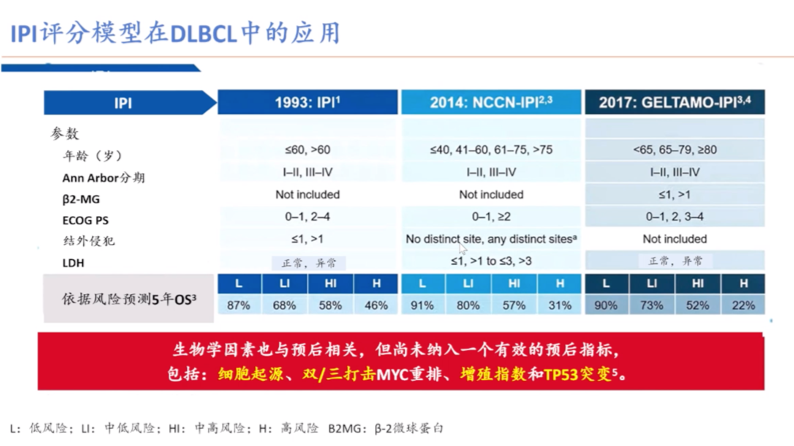 图3: 不同版本IPI评分模型在DLBCL中的应用
图3: 不同版本IPI评分模型在DLBCL中的应用
FISH检测可在分子遗传层面进一步将患者分层。癌细胞驱动基因MYC的断裂会使细胞出现肿瘤特性,包括血管生成更加旺盛、细胞黏附性更差等,造成免疫监察功能下降,宿主细胞分化加强,加速凋亡,从而导致肿瘤不断生长。其中,双打击(MYC、BCL2或BCL6阳性)患者的预后非常差,单打击(MYC阳性)患者的预后也劣于野生型患者,PFS和OS相对较低。但也有多因素研究分析发现,双/三打击对预后的影响仅在确诊后的2年内表现明显。
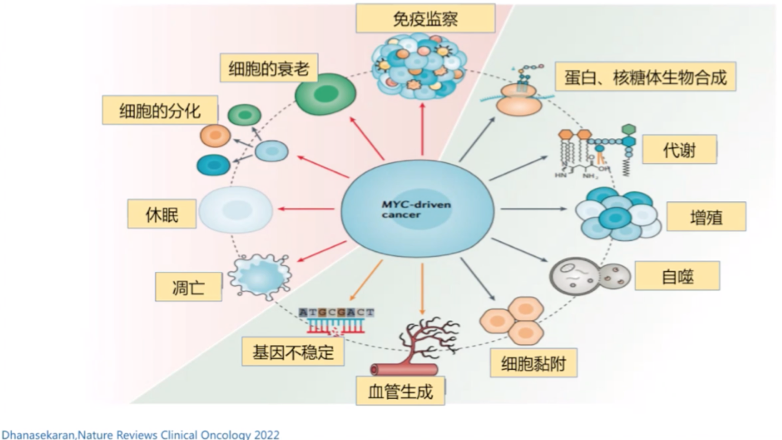 图4: MYC在肿瘤驱动中扮演的角色
图4: MYC在肿瘤驱动中扮演的角色
目前也有一些伴MYC重排的DLBCL患者治疗相关临床研究。例如,DA-EPOCH-R治疗的4年OS率76.7%(n=53, 治疗6周期,中位随访55.6 mo),显示该方案对MYC重排有一定对抗作用;R-CHOP+来那度胺治疗的2年DFS和2年OS率分别为76%和73%(n=82, 6周期,21d/周期,中位随访25.4 mo),疗效尚可。但一项自体造血干细胞移植研究显示移植并不能克服伴MYC重排不良预后,另一项强化免疫化疗方案,包括R-DA-EPOCH和R-HyperCVAD/MA交替,相比R-CHOP也不能克服伴MYC重排不良预后。令人欣喜的是CAR-T用于高危DLBCL一线治疗后客观缓解率(objective response rate, ORR)可达89%(n=37, 双/三打击,IPI评分4/5,R-CHOP(48%),DA-EPOCH-R(45%),CAR-T(Axi-cell),中位随访15.9 mo),但该项研究随访时间较短,还需观察长期疗效。
“R-CHOP适合于双表达、单打击、局限期双打击、IPI评分0分的患者;DA-EPOCH-R则用于其他的双/三打击患者治疗,同时要给予中枢的预防”,孙国珍教授总结道,虽然在MYC重排方面进行了一些尝试,但其指导临床实践尚有不足,需要重新定义高风险人群,制定新的治疗策略。
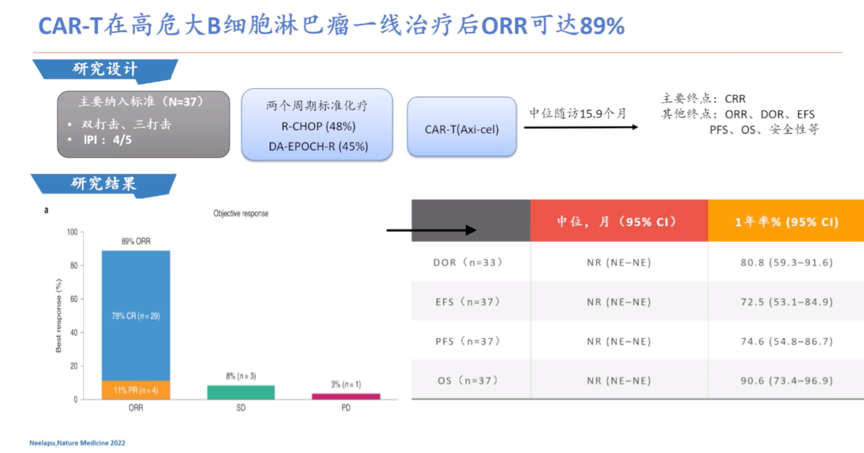 图5:CAR-T在高危DLBCL一线治疗后取得可喜的客观缓解率
图5:CAR-T在高危DLBCL一线治疗后取得可喜的客观缓解率
NGS-基因分型
重新定义高风险人群来制定新的治疗策略,涉及到NGS和最新的基因分型方式。 依据细胞来源、淋巴基因测序,依赖的基因特征和细胞共识集群的不同分型方法,具有一定的契合性,可将DLBCL分为预后良好、适中及差三个级别。
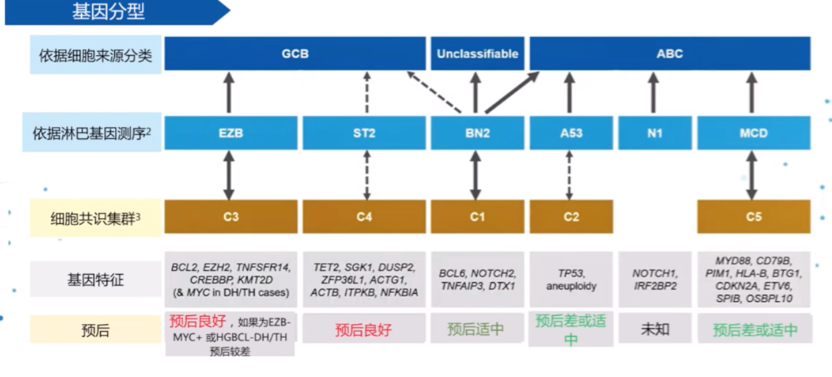
图6:不同基因分型方法比较
孙国珍教授指出,DLBCL作用机制复杂,肿瘤微环境,NF-κB/PI3K等相关致癌/抑癌通路、MYC88等基因表达、凋亡通路等都会通过不同途径导致疾病的异质性,针对MYD88突变可选择BTK抑制剂,NF-κB激活可以选择蛋白酶体抑制剂,细胞凋亡异常则可选择维奈托克等,生物学治疗靶点的正确选择是影响疾病进展的关键因素。
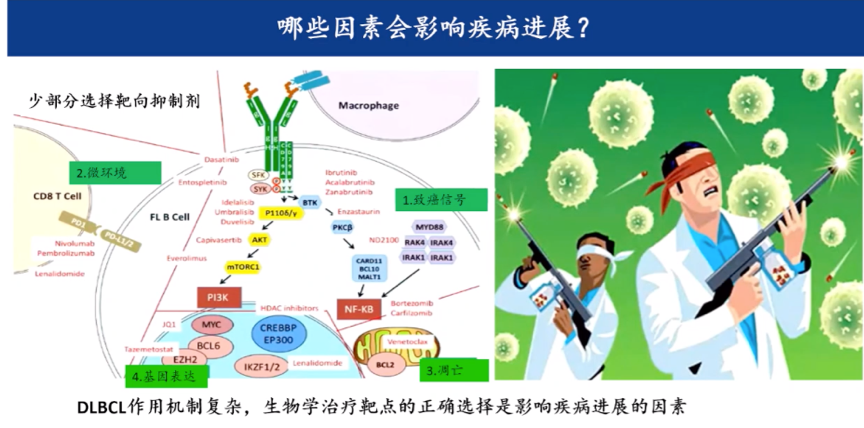
图7:影响DLBCL进展的因素
2018年的两项研究分别通过全外显子及全转录子测序等技术将 DLBCL分别划分为5个(C1-C5及4 个(MCD、BN2、N1 、EZB)分子类型,即Harvard分型和NCI分型,与2020年的UK HMRN分型研究结果有共同点,都发现了基因的集群性表达特性。例如,MCD/C5/MYD88分型多为ABC亚型患者,以MYD88位点和CD78B突变为主要特征,预后较差。EZB/C3/Bcl-2分型以GCB亚型居多,以Bcl-2易位和EZH2激活突变为主要特征,预后也较差。孙国珍教授指出,基因分类最大的可变性来源是患者是否被分类,而不是分到哪一类,上述分型基本适合患者分类。但谈及上述分型可否指导预后,孙国珍教授表示“并不可靠,因为不同分类方式患者的分组不一样”,例如NCI分型中N1和MCD亚型生存预后较差,ST2生存良好,但Harvard和HMRN分型中这些患者预后差别不大,此外另一项HMRN预后分析用了R-CHOP样和R-CHOP两种方案,R-CHOP样方案中有MYD88表达的患者预后更差,但R-CHOP方案却并未提示有MYD88表达预后会更差,说明基因表达用于预后预测有局限性,其价值在于判断生物学性质,相较之下IPI仍然是有用的预后预测因素。
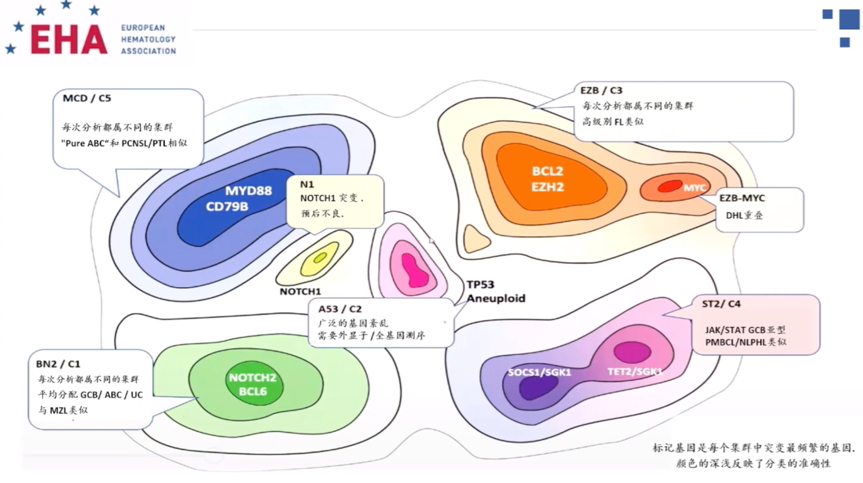
图8:分子分型的共性和基因的集群性表达
那么NGS能否能指导最佳治疗方式的选择?答案是尚不可以,因为目前未经大量临床试验验证的“流行治疗”作为标准治疗的效果并不好,需要更多前瞻性生物学临床研究和临床前亚组分类模型来判断基因治疗的有效性及其疗效,但一些特定亚型的反应相关数据是令人鼓舞的。例如著名的Phoenix研究——Ibrutinib联合R-CHOP治疗NGC(non-germinal center,非生发中心)-DLBCL的随机II期试验,发现不同的基因亚群对生物靶向药物的反应不同,年轻患者中MCD亚型的治疗反应最好,无事件生存获益更大,所以可指导不同等级高危DLBCL的下一步用药。
“样本是否合格、新鲜标本运输、测序平台技术差异等,这些都是目前常规开展NGS实践中面临的挑战,但NGS优势也很明显,在克服上述问题后,依据实验和真实世界数据库建立分子学知识体系,进行科学探索,反复临床验证,这是一个长期的工作”,孙国珍教授总结道,NGS是一个指导方向,克服了以往复发难治的疾病经基因检测后才能得到有效治疗的弊端,但未来仍需在真实世界研究中进一步探索,以期早日实现对高危DLBCL患者的精准分层治疗。
王亚兰主席点评
本次大咖谈主席王亚兰教授点评道,R-CHOP方案仅仅能治愈60%的DLBCL患者,识别高风险患者是精准治疗的关键。在所有识别工具中,IPI评分、细胞来源、FISH检测等有一定价值同时也有局限性。目前来看分子分型是比较前沿的策略,NGS是未来指导分型的重要方向,但需要更多临床研究大数据的支持。
栏目介绍
《血液大咖谈》系列线上课程由神州细胞工程有限公司联合健康界策划出品,以「淋巴瘤」与「血友病」的诊疗进展为出发点,内容涉及边缘区淋巴瘤的规范诊治、套细胞淋巴瘤的诊疗最新进展、弥漫大B细胞淋巴瘤治疗方案的探索、血友病A合并抑制物治疗的困境和希望、血友病B的临床分型与替代治疗等热门话题。
锁定健康界直播间,各路专家云集,对各种血液病的诊治与预防、最新前沿研究做出详细解读,以供临床工作者参考。